
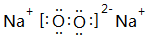 .
. 分析 C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)C为磷元素,原子核外电子数为15,结合能量最低原理书写;
(2)A为O元素,有O2、O3两种同素异形体,均属于分子晶体,相对分子质量越大,分子间作用力越强,物质的沸点越高;A、B、D三元素组成的化合物为NaClO等,
(3)C和D反应可生成1:3的化合物E为PCl3,分子中P原子形成3个P-Cl键,还含有1对孤对电子;
(4)A和B能够形成化合物1:1的化合物Na2O2,由钠离子与过氧根离子构成.
解答 解:C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)C为磷元素,原子核外电子数为15,核外电子排布式为:1s22s22p63s22p3,
故答案为:1s22s22p63s22p3;
(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对原子质量较大,则范德华力较大,沸点较高;A、B、D三元素组成的化合物为NaClO等,含有离子键、共价键,
故答案为:O3;O3相对原子质量较大,范德华力较大;离子键、共价键,
(3)C和D反应可生成1:3的化合物E为PCl3,分子中P原子形成3个P-Cl键,还含有1对孤对电子,分子空间结构为三角锥形,P原子采取sp3杂化,
故答案为:三角锥形;sp3;
(4)A和B能够形成化合物1:1的化合物Na2O2,由钠离子与过氧根离子构成,电子式为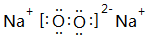 ,
,
故答案为: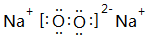 .
.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、沸点比较、空间构型与杂化方式判断、电子式等,关键是根据核外电子排布规律推断元素,掌握熔沸点高低比较方法.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
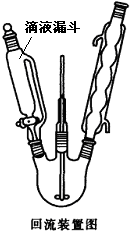 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn>Cu | B. | Al>Mn | C. | Mg>Al | D. | Mn>Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com