


分析 X的相对分子质量为100,Z是温室气体,X高温分解得Y和Z,所以X为CaCO3,Y为CaO,Z为CO2,根据题中各物质转化关系及条件可知,CaO与C在高温条件下反应生成H为CaC2,与水生成K和M,M与氯化氢反应得T,T在一定条件下反应生成Q,Q是日常生活中常见的塑料,不能作食品的包装材料,所以Q为 ,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,据此答题.
,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,据此答题.
解答 解:X的相对分子质量为100,Z是温室气体,X高温分解得Y和Z,所以X为CaCO3,Y为CaO,Z为CO2,根据题中各物质转化关系及条件可知,CaO与C在高温条件下反应生成H为CaC2,与水生成K和M,M与氯化氢反应得T,T在一定条件下反应生成Q,Q是日常生活中常见的塑料,不能作食品的包装材料,所以Q为 ,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,
,据此可以反推得K为Ca(OH)2,M为C2H2,T为CH2=CHCl,
(1)根据上面的分析可知在,X为CaCO3,H为CaC2,H的名称是碳化钙,
故答案为:CaCO3;碳化钙;
(2)反应Ⅲ为乙炔与氯化氢发生加成反应生成氯乙烯,所以反应类型为加成反应,
故答案为:加成反应;
(3)反应Ⅳ的化学方程式为nCH2=CHCl$\stackrel{催化剂}{→}$ ,
,
故答案为:nCH2=CHCl$\stackrel{催化剂}{→}$ ;
;
(4)T为CH2=CHCl,将T通入溴的四氯化碳溶液中,由于中有碳碳双键,可以与溴发生加成反应,所以反应的现象是溴的四氯化碳溶液褪色,反应的化学方程式为CH2=CHCl+Br2→CH2BrCHBrCl,
故答案为:溴的四氯化碳溶液褪色;CH2=CHCl+Br2→CH2BrCHBrCl.
点评 本题考查了物质的推断与性质,抓住常见物质的相对分子质量和用途是解答的关键,题目难度中等,答题时注意化学用语的规范表达.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是在高温下,Fe与水蒸气的反应实验.
如图是在高温下,Fe与水蒸气的反应实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
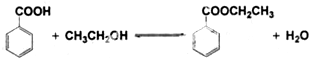
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
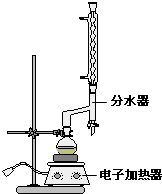
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比 CO体积分数/% 温度/℃ | $\frac{n{H}_{2}O}{n(CO)}$=1 | $\frac{n{H}_{2}O}{n(CO)}$=3 | $\frac{n{H}_{2}O}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某原子K层上只有一个电子 | |
| B. | 某原子M层上电子数为L层电子数的4倍 | |
| C. | 某离子M层上的电子数为K层的4倍 | |
| D. | 阴离子的最外层电子数可能为2,也可能为8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com