
分析 n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,n(NO)+n(NO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
(1)被还原的硝酸的物质的量等于生成气体的物质的量;
(2)先根据硝酸的总量计算起酸作用的硝酸的物质的量,根据酸和铜的物质的量的关系判断哪种物质过量;根据铜原子守恒计算参加反应的铜的物质的量;(3)当向反应后的溶液加稀硫酸后,溶液又有硝酸了,所以剩余的铜又和稀硝酸反应生成一氧化氮,先根据硝酸和铜的物质的量判断铜是否过量,然后根据不足量的物质计算生成一氧化氮气体的体积.
解答 解:(1)4.48L(标准状态)NO和NO2的混合气体的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,无论硝酸被还原成一氧化氮还是二氧化氮,根据氮原子守恒知,被还原的硝酸与气体物质的量之比为1:1,所以被还原的硝酸的物质的量是0.2mol,故答案为:0.2mol;
(2)32.0gCu的物质的量=$\frac{32g}{64g/mol}$=0.5mol,50mL 12mol/L的硝酸的物质的量=12mol/L×0.05L=0.6mol,由(1)知被还原的硝酸的物质的量是0.2mol,所以剩余硝酸0.6mol-0.2mol=0.4mol,如果铜完全被氧化成铜离子,生成硝酸铜需要硝酸的物质的量(起酸作用的硝酸的物质的量)为0.5mol×2=1mol>0.4mol,所以铜剩余.根据铜原子守恒得,铜被氧化的物质的量=$\frac{1}{2}$起酸作用的硝酸的物质的量=$\frac{1}{2}$×0.4=0.2mol,所以还剩余铜0.5mol-0.2mol=0.3mol,故答案为:铜;0.3mol;
(3)当向反应后的溶液中加稀硫酸后,溶液相当于又变成硝酸溶液,根据铜和稀硝酸反应的方程式计算生成气体的体积,
根据(2)知,硝酸的物质的量为0.4mol,铜的物质的量为0.3mol,根据铜和稀硝酸反应的方程式知,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3 2 44.8L
0.3mol 0.2mol 4.48L
0.2mol<0.4mol,所以硝酸过量,
根据铜和硝酸的反应方程式知,生成气体的体积为4.48L.
故答案为:4.48L.
点评 本题考查了氧化还原反应的有关计算,难度较大,注意:如果题目中告诉两种反应物的量,要进行过量计算,然后根据不足量的物质为标准进行计算.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、CO32- | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、NO3- | D. | Na+、Mg2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
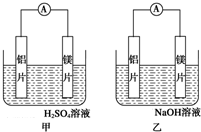 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒容通入惰性气体 | B. | 恒压时通入惰性气体 | ||
| C. | 恒容通入COCl2气体 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥HI气体 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | Cl2与SO2以等物质的量比同时通入品红溶液,能增强其漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Si>O | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 碱性:CsOH>KOH>NaOH | D. | 失电子能力:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸 | |
| B. | 在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素 | |
| C. | 镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱 | |
| D. | 溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑥⑦ | C. | ⑤⑥⑦ | D. | ③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com