
将1mol/L硝酸溶液逐滴加入某合金(仅含铜、铁)中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是( )
| A.若金属有剩余,则剩余金属一定含Cu . |
B.若硝酸溶液体积为100ml,反应后金属有剩余,则可计算产 生NO的物质的量. 生NO的物质的量. |
| C.若金属恰好全部溶解后,再加硝酸溶液仍能产生NO. |
| D.若金属全部溶解,则溶液中一定含Fe3+、Cu2+. |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论或解释 | ① | 将40g NaOH溶于1L蒸馏水中 | 该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1molL-1 | ② | 向盛有1mL 0.1mol?L-1AgNO3溶液的试管中滴加0.1molL-1NaCl溶液,至不再有沉淀生成,再向其中滴0.1molL-1 KI溶液,白色沉淀转化为黄色沉淀. |
常温下 Ksp(AgCl)<Ksp(AgI) |
③ | 某盐NaX溶液pH>7 | 酸HX为弱酸 | ④ | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 说明溶液中一定含有Fe2+ | ⑤ | 向盛有浓硝酸的试管中分别加入Al片和 Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
还原性Al<Cu | ⑥ | BaSO4的水溶液导电性很差 | BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用带玻璃塞的棕色试剂瓶存放浓硝酸 | B、将标况下22.4LHCl溶于1L水中可配制1mol?L-1的盐酸 | C、31g白磷(P4为正四面体结构)所含共价键数为6.02×1023 | D、向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
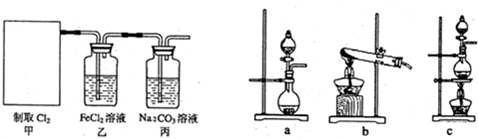
查看答案和解析>>
科目:高中化学 来源: 题型:
无水醋酸钠和碱石灰混合加热,可发生如下化学反应:
CH3COONa + NaOH(CaO) CH4↑ + Na2CO3
(1)将1mol/L的CH3COOH溶液和2mol /L的NaOH溶液等体积混合,加热蒸发溶剂,蒸干后再充分加热至化学反应停止,在此全过程中发生化学反应的化学方程式是: ; 。
(2)将A盐的固体和截石灰混合,微热时放一种气体B,再使温度缓缓升高时又生成一种
新气体C,在同温同压下,气体B和C的密度约相等。将上述反应后余下的固体溶于稀硝酸时,又生成了新气体D,气体D通过盛有Na2O2的干燥管时生成O2。
①写出下列物质的化学式:
A. B. C.
②写出生成气体D的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com