
分析 根据反应2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O可以根据消耗KMnO4的量推出C2O42-的物质的量,根据Ca2++C2O42-=CaC2O4可以计算Ca2+的物质的量,推算出CaCO3的质量,确定该样中CaCO3的质量分数.
解答 解:已知c($\frac{1}{5}$KMnO4)=0.1012mol/L,
滴定消耗高锰酸钾n(KMnO4)=$\frac{1}{5}$×c($\frac{1}{5}$KMnO4)×V=$\frac{1}{5}$×0.1012mol/L×0.02762L=5.59×10-4mol
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
2 5
5.59×10-4mol n(C2O42-)
n(C2O42-)=5.59×10-4mol×$\frac{5}{2}$=1.4×10-3mol
Ca2++C2O42-=CaC2O4
1 1
n(Ca2+)1.4×10-3mol
n(Ca2+)=1.4×10-3mol而Ca2+全部来自于溶解的CaCO3,根据钙元素守恒可知n(CaCO3)=1.4×10-3mol,
m(CaCO3)=n(CaCO3)×M(CaCO3)=1.4×10-3mol×100g/mol=0.14g,
该样中CaCO3的质量分数=$\frac{m(CaCO3)}{m(样品)}$=$\frac{0.14g}{0.1427g}$×100%=98.1%,
答:该样中CaCO3的质量分数为98.1%.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析判断及计算能力,明确各个物理量之间的关系式是解本题关键,注意单位换算.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | CO2 | HClO | Fe(OH)3 |
| 非电解质 | 蔗糖 | BaSO4 | 酒精 | H2O |
| 混合物 | 漂白粉 | 胆矾 | 盐酸 | 液氯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 504mL | B. | 112mL | C. | 336mL | D. | 224mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 冰晶石能降低Al2O3的熔点,用Al2O3炼铝时加入它可减少能耗 | |
| B. | Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 | |
| C. | 氧化钠能与H2O、CO2反应,可用作漂白剂和供氧剂 | |
| D. | 常温时浓硝酸与铁不反应,可用铁桶贮存浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

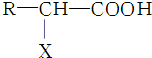 ,X的名称为氨基.
,X的名称为氨基. )易水解,其水解反应的产物为乙酸和
)易水解,其水解反应的产物为乙酸和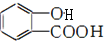 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ≥7 | B. | ≤7 | C. | 一定等于7 | D. | 可能大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
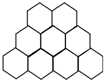 石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )
石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )| A. | 3:2 | B. | 2:1 | C. | 1:3 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
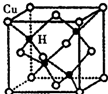 (1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
(1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.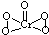 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com