
分析 (1)醋酸是弱酸,不完全电离;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(3)由C(H+)=$\sqrt{Ka×c(C{H}_{3}COOH)}$计算出氢离子浓度,然后计算氢离子浓度之比.
解答 解:(1)醋酸为弱酸,液中部分电离,电离方程式用可逆符号,电离方程式为CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-;
(2)a.加水稀释促进弱酸的电离,则醋酸的电离程度增大,故正确;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
d.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
e.加入少量醋酸钠固体,醋酸根离子浓度增大,抑制醋酸的电离,则醋酸的电离程度减小,故错误;
f.加入少量0.10mol/L 的NaOH溶液,消耗氢离子,电离平衡正向移动,则醋酸的电离程度增大,故正确;
故答案为:abf;
(3)0.10mol•L-1CH3COOH溶液中C(H+)=$\sqrt{Ka×c(C{H}_{3}COOH)}$mol/L=$\sqrt{1.75×1{0}^{-5}×0.1}$mol/L=$\sqrt{1.75}$×10-3mol/L,0.0010mol•L-1 CH3COOH溶液中C(H+)=$\sqrt{Ka×c(C{H}_{3}COOH)}$mol/L=$\sqrt{1.75×1{0}^{-5}0.001}$=$\sqrt{1.75}$×10-4mol/L,其c(H+)之比为①:②=$\sqrt{1.75}$×10-3mol/L:$\sqrt{1.75}$×10-4mol/L=10:1;
故答案为:10:1.
点评 本题考查了弱电解质的电离、弱电解质电离常数的有关计算、电离方程式的书写等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握外界条件对电离平衡的移动.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.| 滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(B2)=1.2mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(B2)=0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
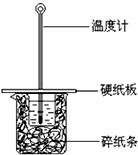 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )| A. | 采用0.55mol/L的NaOH溶液是保证盐酸完全被中和 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是保温隔热,防止热量损失 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④②① | B. | ①②③④ | C. | ④③②① | D. | ④①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
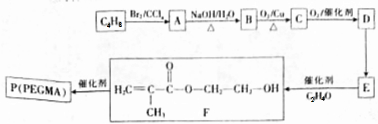
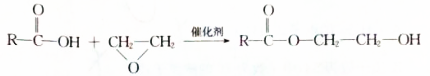
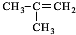 .
.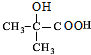 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$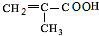 +H2O,该反应的反应类型是消去反应.
+H2O,该反应的反应类型是消去反应.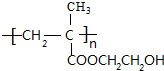 .
.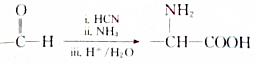 .设计由B合成
.设计由B合成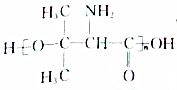 的路线.合成路线流程图请参考如下形式.
的路线.合成路线流程图请参考如下形式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com