
| 容器 | 体积 | 起始物质 | 平衡时C的 物质的量 | 平衡时B的 体积分数 | 平衡常数 |
| 甲 | 1L | 1molA+2molB | 1mol | φ甲 | K甲 |
| 乙 | 1L | 4molC+2molD | n1mol | φ乙 | K乙 |
| 丙 | 2L | 4molC+2molD | n2mol | φ丙 | K丙 |
| A、在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大 |
| B、K甲=K丙>K乙 |
| C、升高甲的温度,可使φ甲=φ乙 |
| D、n1=1.6,n2=2 |
| 12×0.5 |
| 12 |
| 4-n1 |
| 1 |
| n1 |
| 2 |
n12×
| ||
(
|
| 4-n2 |
| 2 |
| n2 |
| 4 |
(0.5n2)2.
| ||
(
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| A、乙醇和钠反应键②断裂 |
| B、在Ag催化下和O2反应键①③断裂 |
| C、乙醇和浓H2SO4共热,在140℃时,键①或键②断裂 |
| D、乙醇和浓H2SO4共热,在170℃时,键②⑤断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原于有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原于有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-5-乙基庚烷 |
| B、有机物(图2)的一种芳香族同分异构体能发生银镜反应 |
| C、高分子化合物(图3),其单体为对苯二甲酸和乙醇 |
| D、等质量的乙炔和苯完全燃烧生成水的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键是相邻原子间的相互吸引力 |
| B、离子键是阴、阳离子通过静电作用形成的化学键 |
| C、共价键只存在于共价化合物中 |
| D、非金属元素的原子之间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将二氧化碳通人硅酸钠溶液以证明碳酸的酸性比硅酸强 |
B、如图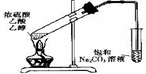 装置中,导管不能伸人液面的原因是产物易溶于水 装置中,导管不能伸人液面的原因是产物易溶于水 |
| C、用碱石灰可干燥氯气 |
| D、用普通玻璃棒蘸取溶液做焰色反应以证明溶液含有Na十 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,向0.1mol?L-1NaAlO2溶液中逐滴加入0.1mol?L-1稀盐酸,实验测得溶液pH随盐酸体积变化的曲线如图,下列有关说法正确的是( )
室温下,向0.1mol?L-1NaAlO2溶液中逐滴加入0.1mol?L-1稀盐酸,实验测得溶液pH随盐酸体积变化的曲线如图,下列有关说法正确的是( )A、a点时,溶液呈碱性的原因是Al
| ||||
B、a→b段,溶液pH减小,Al
| ||||
| C、b→c段,加入的盐酸主要用于生成Al(OH)3沉淀 | ||||
| D、d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
| A、第一组反应pH升高是因为O3氧化I的反应是消耗H+的过程 |
| B、物质A可能是Fe2+ |
| C、Fe2+生成A的过程中,I的转化率显著提高的原因可能是溶液酸性增强,使②、③步骤平衡右移,转化率提高 |
| D、第2组实验18s后,c(I3-)下降的其中一个原因可能是I2(g)的不断生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com