
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越小 |
分析 A.可溶性淀粉溶液中滴加碘水,不存在碘分子;
B.用玻璃棒摩擦是为了产生适量的晶核;
C.蒸发时要防止晶体分解;
D.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大.
解答 解:A.因为碘和淀粉形成络合物,不存在单独的碘分子,故不能被萃取,故A正确;
B.太过干净的容器使得溶液里面没有晶核,因此很难析出晶体,用玻璃棒摩擦是为了产生适量的晶核,从而析出晶体,故B正确;
C.蒸发时要防止晶体分解,可加热至溶液表面出现晶膜为止,故C正确;
D.一般说来,若将滤液迅速冷却并剧烈搅拌,则所析出的晶体很细,总表面积大,因而表面上吸附或粘附的母液总量也较多.若将滤液静置并缓缓降温,得到的晶体较大,故D错误.
故选D.
点评 本题考查较为综合,涉及萃取、蒸发、结晶等知识,侧重于考查学生化学实验的评价能力,为高考常见题型,注意把握相关物质的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂和蛋白质都是高分子化合物 | |
| C. | 乙醇、乙酸均能与Na反应放出H2,但二者分子中官能团不同 | |
| D. | 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
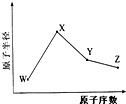 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,转移8mol e- | |
| D. | 该反应中H2O是反应物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 | |
| B. | 苯及其同系物均不能使溴水和酸性高锰酸钾溶液褪色 | |
| C. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| D. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com