
 ��
��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| ָʾ�� | ʯ�� | ���� | ���� | ��̪ |
| ��ɫ��Χ��PH�� | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
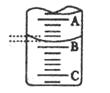
| ʵ����� | ��һ�� | �ڶ��� | ������ |
| ����NaOH��Һ���/ml | 26.02 | 25.32 | 25.28 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʹ�÷ֹ��ȼƣ����Ի���õ�ij��Һ��Ũ�� |
| B��pH��ֽ�ǽ���ֽ�ö������ָʾ���Ļ��Һ���������ɺ��Ƴɵ� |
| C���ڵζ������У��μ���Һ���ٶȲ���̫�죬һ����ÿ��3-4��Ϊ�� |
| D����Һ�ܹܼ������Һ��һ��Ҫ��ϴ�����Ա�֤��ȡҺ�������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ��pH���� | B��CH3COOH����̶ȱ�� |
| C����Һ�ĵ����������� | D����Һ��c(OH��)��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2CO(g)+O2 (g)=2CO2(g)��H = �D556kJ��mol-1 |
| B��CH4(g)+2O2(g)=CO2 (g)+2H2O (l)��H = �D890kJ��mol-1 |
| C��2H2 (g)+O2(g)=2H2O(l)��H = �D571.6kJ��mol-1[ |
| D��H2 (g)+Cl2(g)=2HCl(g)��H = �D184.6kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ͬ�¶��£�1 mol��L-1������Һ��0.5 mol��L-1������Һ�У�c��H+��֮����2��1 |
| B�����������Һ�м����������ᣬʹ���Һ��pH=7����ʱ���Һ��c��Na+��=c��CH3COO-�� |
| C��pH=3������ʹ����ˮʹ��Һ����ֱ�����100����pH����ͬ |
| D��0.1 mol��L-1NH4Cl��Һ��c(NH4+)+c��H+��=c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
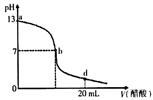
| A��������������Һ�����ʵ���Ũ��Ϊ0.1 mol/L �� |
| B����b�㣬c (Na+��=c(CH3COO-�� |
| C����d�㣬��Һ����������Ũ���ɴ�С��˳��Ϊ c (CH3COO-��>c (Na+)>c (H+��>c (OH-�� |
| D������������Һ�������Һǡ����ȫ��Ӧ�ĵ�λ������b��d���ij�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �ľ���ֵ����ȷ��
�ľ���ֵ����ȷ��| A��C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g)����H=" ��1367.0" kJ/mol��ȼ���ȣ� |
| B��NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)����H=" +" 57.3kJ/mol���к��ȣ� |
| C��P(s)+ 3/2 Cl2(g)="==" PCl3(g)����H=" ��306" kJ/mol����Ӧ�ȣ� |
| D��2NO2==O2+2NO����H=" +" 116.2kJ/mol����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������������mol/L������ | B��������������mol/L���� |
| C��������������mol/L������ | D����������������mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com