


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.以上四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 3A2(g)+B2(g)的平衡常数为 。
3A2(g)+B2(g)的平衡常数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
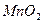 ,反应的化学方程式为 。
,反应的化学方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
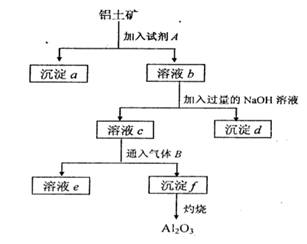
 ;d ;
;d ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com