
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.24 g NaH中阴离子所含电子总数为NA
B.标准状况下,22.4 L苯中含有C—H键数目为6NA
C.在碳酸钠溶液中,若c(CO32-)=1mol/L,则c(Na+)=2mol/L
D.通过MnO2催化使H2O2分解,产生32 g O2时转移电子数为2NA
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:___________________。
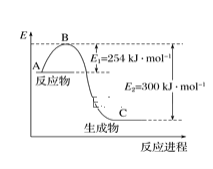
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
②N2(g)+O2(g)═2NO(g) ΔH2=-bkJ·mol-1
若1molNH3还原NO至N2,则该反应过程中的热化学方程式:________。(用含a、b的式子表示ΔH3)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应 Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应 Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
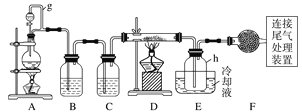
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:____________________________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h瓶需要冷却的理由是________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO![]() +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由:
____________________________________________________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:

(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
(4)实验室中制取SO2的原理为:Na2SO4+H2SO4=Na2SO4+H2O+SO2↑,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
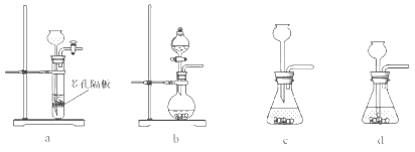
(5)粗硒中硒的含量可用如下方法测定:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H=2H2O②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O③I2+2Na2S2O3=Na2S4O6+2NaI通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量,滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol/L的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
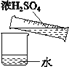
A.下列各项(①温度;②浓度;③容量;④刻度;⑤刻度线),其中容量瓶上标有①③④
B.用18.4 mol/L的硫酸配制1 mol/L稀硫酸的实验有如图所示的操作
C.容量瓶用蒸馏水洗净后要烘干以除去残留的水
D.若用含有Na2O的NaOH配制溶液,则所配溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_____________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
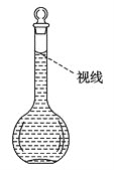
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有18.4 g由NaOH与NaHCO3组成的固体混合物,将它们在密闭容器中加热到250℃,经充分反应后排出气体,冷却,称得剩余固体的质量为16.6 g。试计算原混合物中NaOH的质量分数_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
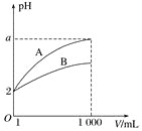
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液的酸性强
C.a=5时,A是强酸,B是弱酸
D.一定有关系:5>a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将N2、H2混合气体100 mL通入密闭容器内,达到平衡时,容器内的压强比反应前减小![]() ,测得此时混合气体的平均相对分子质量为9。试求:
,测得此时混合气体的平均相对分子质量为9。试求:
(1)原混合气中N2、H2各多少毫升______?
(2)H2的转化率是多少______?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com