
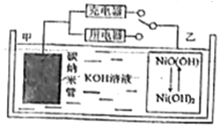
 氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )
氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 可开发氢燃料电池用于电动汽车 | |
| C. | 电池总反应为H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2 | |
| D. | 充电时,乙电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
分析 开关连接用电器时,应为原电池原理,甲电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;开关连接充电器时,为电解池,充电与放电过程相反,据此解答.
解答 解:A.放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH-向负极甲电极移动,故A错误;
B.可开发氢燃料电池用于电动汽车,减小污染,故B正确;
C.放电时,正极电极反应式为2NiO(OH)+2H2O+2e-═2Ni(OH)2+2OH-,负极电极反应式为:H2+2OH--2e-═2H2O,则两式相加得总反应:H2+2NiOOH $?_{充电}^{放电}$2Ni(OH)2,故C错误;
D.放电时,乙电极为正极得电子发生还原反应,充电则发生失电子的氧化反应,电极反应为:Ni(OH)2-e-+OH-═NiO(OH)+H2O,故D错误;
故选B.
点评 本题考查了化学新型电池,明确正负极上发生的电极反应及阴阳离子的移动方向即可解答,注意放电与充电过程的关系,侧重考查学生的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
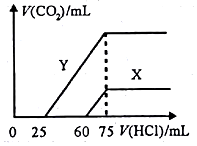
| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: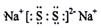 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
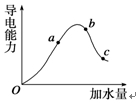 一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以观察到酸性高锰酸钾溶液褪色 | |
| B. | 溴乙烷能发生消去反应 | |
| C. | 该实验现象不能说明产生的气体中一定有乙烯 | |
| D. | 向反应后溶液中滴加AgNO3溶液可验证Br-的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
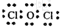 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将等物质的量的SO2与Cl2混合后,通入品红溶液 | 品红褪色 | SO2、Cl2都能使品红褪色 |
| B | 将Fe2O3溶于足量氢碘酸溶液,然后滴入淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W |
| A. | 原子半径:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Z与Y的简单离子的电子层结构相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | X的简单氢化物与Y的氢化物化合产物中含有离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com