
分析 (1)二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)浓盐酸有挥发性,所以制取的氯气中含有氯化氢气体和水蒸气,氯化氢极易溶于水,饱和食盐水中含有氯离子,能抑制氯气的溶解,浓硫酸具有吸水性可以干燥氯气;
(3)依据氯气与水反应生成盐酸和次氯酸,盐酸具有酸性、次氯酸具有漂白性解答;
(4)氯气与水反应生成盐酸和次氯酸,次氯酸见光分解生成氯化氢和氧气;
(5)依据二价铁离子还原性强于溴离子,溴化亚铁溶液加氯水先氧化二价铁离子再氧化溴离子,结合三价铁离子遇到KSCN溶液显血红色设计实验验证.
解答 解:(1)二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
(2)浓盐酸有挥发性,所以制取的氯气中含有氯化氢气体和水蒸气,氯化氢极易溶于水,饱和食盐水中含有氯离子,能抑制氯气的溶解,所以可以用饱和食盐水除去氯气中的氯化氢,浓硫酸具有吸水性可以干燥氯气,
故答案为:饱和食盐水、浓硫酸;
(3)氯气与水反应生成盐酸和次氯酸,盐酸具有酸性能够使石蕊变红、次氯酸具有漂白性能够使变红的溶液褪色,所以将氯气通入石蕊试液中,可观察到的现象是先变红后褪色;
故答案为:先变红后褪色;
(4)氯气与水反应生成盐酸和次氯酸,方程式:Cl2+H2O═HCl+HClO,次氯酸见光分解生成氯化氢和氧气,方程式:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
故答案为:Cl2+H2O═HCl+HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(5)二价铁离子还原性强于溴离子,溴化亚铁溶液加氯水先氧化二价铁离子再氧化溴离子,所以向足量FeBr2溶液中滴入几滴饱和氯水,振荡,溶液呈浅黄色,溶液呈浅黄色的微粒是Fe3+,三价铁离子遇到KSCN溶液显血红色,所以取少许浅黄色溶液,滴加几滴KSCN溶液,溶液变红说明推断准确;
故答案为:Fe3+;取少许浅黄色溶液,滴加几滴KSCN溶液,溶液变红说明推断准确.
点评 本题考查了氯气的制备及性质检验,明确氯气制备原理及性质,熟悉氯水成分是解题关键,注意三价铁离子检验方法,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol稀硫酸和1mol稀Ba(OH)2溶液完全中和所放出的热量为中和热 | |
| B. | 中和反应都是放热反应,盐类水解反应都是吸热反应 | |
| C. | 在101kPa时,1mol碳燃烧所放出的热量一定是碳的燃烧热 | |
| D. | 碳与二氧化碳的反应既是吸热反应,也是化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,24gNO2中所含的氧原子数为0.5NA | |
| C. | 常温常压下,11.2LCl2与足量Fe反应,转移电子数为NA | |
| D. | 1mol的羟基与1mol的氢氧根离子所含质子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5、9、6 | B. | 4、9、6 | C. | 3、9、7 | D. | 5、9、10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
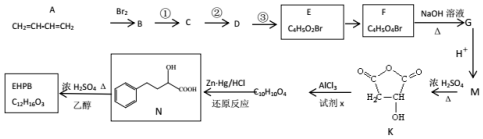
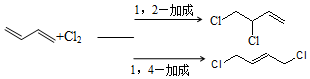
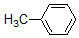 +H3C
+H3C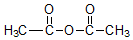 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$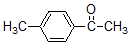 +CH3COOH
+CH3COOH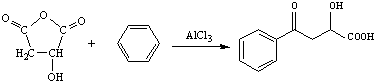 .
.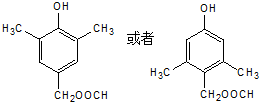 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com