
【题目】下列分子含有“手性”碳原子,属于手性分子的是
A. CH3CH2OHB. CH3CHOC. ![]() D. H2N-CH2-COOH
D. H2N-CH2-COOH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。回答下列问题:
(1)CO2与H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
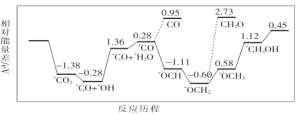
容易得到的副产物有CO和CH2O,其中相对较多的副产物为__;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中__(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(2)恒压(容器的容积可变)下,0.2molCO2与0.6molH2在催化剂作用下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
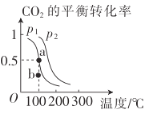
压强p1__(填“<”或“>”)p2。
②在p1、100℃条件下,b点时v正__(填“<"或“>”)v逆。
③已知:反应速率v=v正-v逆=k正![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的![]() =__(保留3位有效数字)。
=__(保留3位有效数字)。
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应(Ⅰ)、(Ⅱ)的lgKP(KP为以分压表示的平衡常数)与T的关系如图所示。
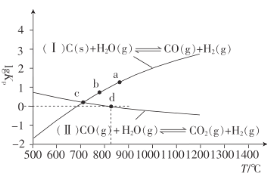
反应(Ⅱ)的△H__(填“大于”“等于”或“小于”)0。
②c点时,反应C(s)+CO2(g)![]() 2CO(g)的KP=__(填数值)。
2CO(g)的KP=__(填数值)。
③在恒容密闭容器中充入0.5molCO、2molH2O(g)只发生反应(Ⅱ),图中d点处达到平衡时,CO的转化率为__;达到平衡时,向容器中再充入0.5molCO、2molH2O(g),重新达到平衡时,CO的平衡转化率__(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活关系密切。下列有关说法错误的是( )
A.港珠澳大桥使用的超高分子量聚乙烯纤维属于有机高分子化合物
B.质谱法是测定有机物相对分子质量及确定化学式的分析方法之一
C.“玉兔二号”月球车使用的帆板太阳能电池的材料是![]()
D.宋·王希孟《千里江山图》卷中绿色颜料“铜绿”的主要成分是碱式碳酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第_________周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为_______。铁离子的电子排布式__________________
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:
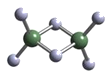
① 分子中A1原子采取____杂化。Al2Cl6属于____分子(填“极性”或“非极性”)。
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________(填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为______________;用物质结构知识说明Fe2+容易被氧化成Fe3+的原因:________________________。
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为_____。
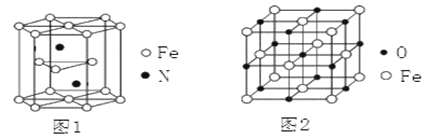
(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2—的最短核间距为_____________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年2月《Nature》报道的一种四室(1#~4#)自供电从低浓度废水中回收铜等重金属的装置如下图所示:
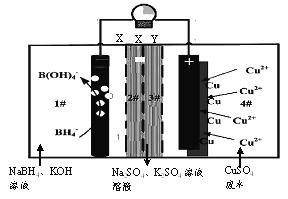
下列说法正确的是
A. 装置工作时,4#室中溶液pH不变
B. X、Y依次为阴离子、阳离子选择性交换膜
C. 负极的电极反应为:BH4-+8OH--8e-=B(OH)4-+4H2O
D. 单位时间内4n(NaBH4)消耗>n(Cu)生成是由于负极上有O2析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一定体积的密闭容器中进行可逆反应N2(g)+3H2(g)![]() 2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
A.容器中N2、H2和NH3三种物质共存
B.容器中N2和H2的分子数之比为1:3
C.容器中N2、H2、NH3的浓度相等
D.NH3的生成速率和分解速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com