
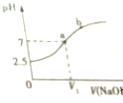
 常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )
常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | HSO3-的电离常数Ka=6.25×10-7 |
分析 A、图象分析可知,在未加入氢氧化钠溶液时亚硫酸氢钠溶液PH=2.5,常温下显酸性;
B、在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液10ml,恰好反应生成亚硫酸钠,溶液中亚硫酸根离子水解显碱性,若溶液呈中性,则加入氢氧化钠溶液体积小于10ml;
C、a点时溶液呈中性,结合溶液中电荷守恒分析判断离子浓度大小;
D、亚硫酸氢钠溶液PH=2.5,HSO3-?H++SO32-,K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$计算分析判断.
解答 解:A、在未加入氢氧化钠溶液时,亚硫酸氢钠溶液PH=2.5,常温下NaHSO3溶液呈酸性,故A正确;
B、在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液10ml,恰好反应生成亚硫酸钠,反应的化学方程式为:NaHSO3+NaOH=Na2SO3+H2O,溶液中亚硫酸根离子水解显碱性,若溶液呈中性,则加入氢氧化钠溶液体积小于10ml,即V1<10mL,故B正确;
C、a点时溶液呈中性,c(H+)=c(OH-),溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),得到c(Na+)=2c(SO32-)+c(HSO3-),故C错误;
D、亚硫酸氢钠溶液PH=2.5,HSO3-?H++SO32-,K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$=$\frac{1{0}^{-2.5}×1{0}^{-2.5}}{0.1-1{0}^{-2.5}}$≈10-4,故D错误;
故选CD.
点评 本题考查了物质反应后的溶液酸碱性判断,图象的特征分析应用,盐类水解和电解质溶液中电荷守恒的理解应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物只有一种 | |
| B. | R的氢化物的热稳定性比W的强 | |
| C. | 原子半径:r(Z)<r(R) | |
| D. | Y的最高价氧化物的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.5mol•L-1 NH4NO3溶液中含氮原子数目6.02×1023 | |
| B. | 标准状况下,22.4L C3H8含有C-H键的数目为6.02×1023 | |
| C. | 32g SO2与足量O2混合充分反应,转移的电子数目为6.02×1023 | |
| D. | 常温下,500mL pH=0的硫酸溶液中含有的H+数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向2mL 2%CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后滴加M溶液,加热 | 未出现砖红色沉淀 | M中不含醛基 |
| B | 在CuSO4溶液中介入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| C | 向有机试剂N中加入2mL5%的NaOH溶液,加热,冷却后取上层溶液滴加几滴AgNO3溶液 | 出现褐色沉淀 | N不是卤代烃 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2已氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.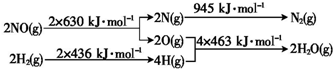
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数X>Y | D. | 质子数Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com