
某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是( )
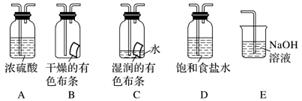
A.按气流流动的先后顺序,装置连接顺序依次为DACBE
B.按气流流动的先后顺序,装置连接顺序依次为DABAE
C.装置E的主要用途是制备NaClO
D.若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列制备金属单质的方法或原理正确的是( )
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为______,A与B在原子的电子层结构上的相同点是________________________
________________________________________________________________________。
(2)易与C发生化学反应的酸是________(写名称),反应的化学方程式是________________________________________________________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:____________________________________
________________________________________________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免_________________。
(2)Br2可用热空气吹出,其原因是________________________________________。
(3)写出步骤③所发生的化学反应方程式___________________________________。
用硫酸而不用盐酸酸化的原因可能是______________。步骤②的产品有时运输到目的地后再酸化,主要是因为________________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中
________________________________________________________________________
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
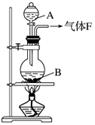
(1)A是浓盐酸,B是二氧化锰,将A滴入B中时发生反应的离子方程式为______________。
(2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积在标准状况下小于1.12 L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:__________。
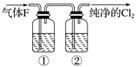
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①__________,②______(填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224 mL标准状况下Cl2完全反应时,则反应过程中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,熵显著增加的反应是( )
A.CO(g)+2H2(g)===CH3OH(g)
B.CaCO3+2HCl===CaCl2+H2O+CO2↑
C.C(s)+O2(g)===CO2(g)
D.2Hg(l)+O2(g)===2HgO(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2常用于制硫酸,其中一步重要的反应为2SO2(g)+O2(g)2SO3(g) ΔH<0。若向一个2 L的密闭容器中充入0.4 mol SO2、0.2 mol O2和0.4 mol SO3,发生上述反应。
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是________(填字母)。
A.c(SO2)=0.3 mol·L-1、c(O2)=0.15 mol·L-1
B.c(SO3)=0.4 mol·L-1
C.c(O2)=0.2 mol·L-1、c(SO2)=0.4 mol·L-1
D.c(SO3)=0.3 mol·L-1
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为________。
(3)某温度时,将4 mol SO2和2 mol O2通入2 L密闭容器中,10 min时反应达到平衡,SO2的转化率为80%,则0~10 min内的平均反应速率v(O2)=________,该温度下反应2SO2(g)+O2(g)2SO3(g)的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com