
ij����ѧϰС����ճ������в���ȱ�ٵĵ�ζƷM����̽������֪C����D��ȼ�շ�����ɫ���森M���������ʵ�ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����
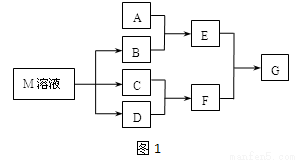
��1��д��F�ĵ���ʽ ��
��2����A��һ�ֳ���������������ҿ��������첣����E��Һ��F��Һ��Ӧ�����Ʊ�һ�ֽ��壬��E��Һ���׳���___________
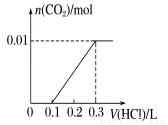
��3����A��CO2���壬A��B��Һ�ܹ���Ӧ����Ӧ�����õ���Һ�������ᷴӦ����ͼ��ʾ����A��B��Һ��Ӧ����Һ�е����ʻ�ѧʽΪ ��
��4����A��һ�ֳ����������ʣ���A��B��Һ�ܹ���Ӧ��������F��Һ��μ���E��Һ���ӱ�����������ʵ�������� ��
��5����A��һ�ֻ��ʣ�ʵ���ҿ���A��B��Ӧ��ȡ����E��E��F��E��D������ð���̣�������E ��D�ķ�Ӧ��������D�Ĺܵ��Ƿ�й¶��д��E��D��Ӧ�Ļ�ѧ����ʽ�� ��

��6����A��һ����Һ��ֻ���ܺ���H+��NH4+��Mg2+��Fe3+��Al3+��CO32����SO42���е�ijЩ���ӣ��������Һ�м���B��Һʱ�������ɳ��������ʵ�����B��Һ����������仯��ͼ.��ʾ���ɴ˿�֪������Һ�п϶����е����Ӽ���Ũ��֮��Ϊ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������������ʡ��ʡ��У��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ӧ3NO2��H2O=2HNO3��NO�У�����6mole������ת��ʱ���������������뱻��ԭ�����ʵ���֮��Ϊ( )
A��1��1 B��1��2 C��2��1 D��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������������ʡ��ʡ��У�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A�������ܹ��ı仯ѧ��Ӧ·��
B�������¶�����˻���Ӱٷ���
C������Ӧ��Ũ������˻���Ӱٷ���
D������ѹǿ���������ӵ�Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ�����ϵڶ��ζο���ѧ�Ծ��������棩 ���ͣ������
�����仯�����������������й㷺Ӧ�á�
��1����֪��CO�ɽ����ֵ��������ﻹԭΪN2��
��Ӧ��2CO(g)+2NO(g) N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ��4CO(g)+2NO2(g) N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
д��CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ ��
��2����һ���Ⱥ��ݵ������г���2mol CO��1mol NO2����������ӦII��������˵����Ӧ�ﵽƽ��״̬���� �� ��
A�������ڵ���ѹǿ���ڱ仯 B��������CO��NO2���ʵ����Ȳ���
C������������ƽ���ܶȲ��� D�������������¶Ⱥ㶨����
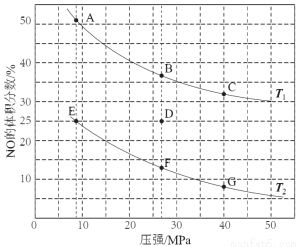
��3�����ܱ������г���5 mol CO��4 mol NO����������ӦI����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��
�ش��������⣺
���¶ȣ�T1 T2����������� ����
��ij�¶��£������Ϊ2 L���ܱ������У���Ӧ����10���ӷų�����373 kJ����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)= ��
������D��Է�Ӧ�������µ�ͬʱ�������ʹ��ϵѹǿ��С�����´ﵽ��ƽ��״̬������ͼ��A~G���е� ��
��4��ij�¶�ʱ����������AgNO2�� Ksp= 9.0��10-4��Ag2SO4��Ksp=4.0��10-5������NO2����SO42�������Һ�м���AgNO3��Һ��SO42��ǡ����ȫ��������SO42��Ũ�ȵ���1.0��10-5 mol��L-1��ʱ��c(NO2��)= mol��L��1��
��5������ͼ�������������£����ˮ��CN-��ת��ΪCO2��N2����д�������ĵ缫��Ӧʽ ��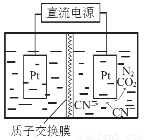
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ�����ϵڶ��ζο���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A����ɫ����Һ�У�Na+��H+��Cl����S2O32��
B��0.1mol��L-1Na2CO3��Һ�У�K+��Al3+��I����Cl��
C��������Һ�У�K+��C2O42����Cl����MnO4��
D�����������Һ�У�Na+��Cu2+��Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ������ͨμ�ظ�����ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ���ǣ� ��
A����ͭ�缫�����������Һ��4Ag++2H2O 4Ag+O2��+4H+
4Ag+O2��+4H+
B��FeS�м�������ϡ���FeS+2H+=Fe2++H2��
C��ʯ��ʯ���ڴ�����Һ�У�CaCO3+2H+=Ca2++H2O+CO2��
D������ʯ��ˮ��ͨ�������CO2��CO2+OH��=HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ��������������ѧ���������棩 ���ͣ������
������Ԫ��W��X��Y��Z��ԭ�������������ӡ�
�� m��p��r������ЩԪ����ɵĶ�Ԫ�����
�� n��Ԫ��Z�ĵ��ʣ�ͨ��Ϊ����ɫ���壻
�� q����ǿ�����ԣ�q��ˮ��Һ������Ư��ɱ����
�� 0.01 mol��L?1r��Һ��pHΪ2��p������л��sͨ����������ˮ�Ļ���
�������ʵ�ת����ϵ��ͼ��ʾ���ش��������⡣
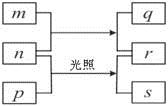
��1��Yԭ�ӵĽṹʾ���ͼ�� ��
��2��X��Y��Z��ԭ�Ӱ뾶�ɴ�С��˳���� ����Ԫ�ط��ű�ʾ����
��3��r�ĵ���ʽΪ ������n����;�� ����дһ�ּ��ɣ���
��4��q������ʵ�����NaOH��Ӧ��õ�����Һ�ʼ��Ե�ԭ���� �������ӷ���ʽ��ʾ����
��5��W��X��Y��ԭ�Ӹ�����Ϊ2 ��1 ��1��ɻ�����t����NaHCO3��Һ��Ӧ�������ݣ������������t����Է�������Ϊ60����������t�� ��д���ƣ���
��6�����³�ѹ��2.4g��p��ȫȼ�շų�133.6kJ���������÷�Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�챱���к�����������ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
H2O2�㷺Ӧ���ڻ�ѧƷ�ϳɡ�ֽ���ͷ�֯Ʒ��Ư�ף��ǻ�����Һ��Ư�������о�������H2O2��Һ��Ư������HO2�����¡�
��1�� H2O2��Һ��������,���0.15 mol��L?1 H2O2��ҺpHԼΪ6��д��H2O2����HO2���ĵ��뷽��ʽ�� ��
��2������������ͬʱ���о���ͬ��ʼpH������H2O2��Һ��Ư��Ч����������£�

����ͼ�ɵõ��Ľ����� �����ƽ���ƶ�ԭ���������ɣ� ��
��3��ʵ�鷢�֣� ��pH >11����H2O2��Һ��Ư��Ч����pH��������͡������һ����������ʵ�飬������Һ��H2O2�ķֽ���pH�йء��ⶨ��ͬ��ʼpH�����£���ʼŨ�Ⱦ�Ϊ0.15 mol��L?1 ��H2O2��Һ�����ֽⷴӦ��������£�
��ʼpH | pH = 10 | pH = 12 |
1Сʱ��H2O2��ҺŨ�� | 0.13 mol��L?1 | 0.07 mol��L?1 |
1Сʱ��pH | û�����Ա仯 | û�����Ա仯 |
�������ϣ�HO2��+H2O2=H2O+O2+OH����
�ٽ�����ӷ���ʽ����1Сʱ��pHû�����Ա仯��ԭ�� ��
�ڴӷ�Ӧ���ʵĽǶȷ���pH����H2O2��ҺƯ��Ч���ή�͵�ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ��������У������ѧ�ڵ�һ��������ѧ���������棩 ���ͣ�ѡ����
ijͬѧͨ��ϵ��ʵ��̽��Al���仯��������ʣ�������ȷ���ܴﵽĿ�ĵ���( )
A������Ƭ����Ũ�����У�̽��Al�Ļ�����
B����NaOH��Һ��������Al2(SO4)3��Һ�У��۲�Al (OH)3���������ɼ��ܽ�
C����Al (OH)3��Һֱ�ӵ�����װ����ֽ��©���й��ˣ�ϴ�Ӳ��ռ�����
D����Al (OH)3����ת���������У�������ϡ���ᣬ�������ɵ���ˮAlCl3����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com