
 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:分析 (1)反应中产物气体数和小于反应物气体系数和,据此判断反应熵变符号;根据盖斯定律确定所求反应和已知反应之间的关系,计算反应的焓变即可;
(2)反应达到平衡状态,各组分的浓度不随着时间的变化而变化,正逆反应速率相等,根据化学平衡状态的特征结合变量不变的状态是平衡状态来回答.
解答 解:(1)反应中产物气体数和小于反应物气体系数和,反应熵变小于零,
反应Ⅰ:CO2(g)+H2(g)?CO (g)+H2O(g)△H1=+41.19kJ•mol-1,
反应Ⅲ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3=-49.58kJ•mol-1,
反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2可以看成是Ⅲ-Ⅰ得到,所以反应焓变=-49.58kJ•mol-1-41.19kJ•mol-1=-90.77 kJ•mol-1,
故答案为:<;-90.77 kJ•mol-1;
(2)A.断裂3molH-H键,同时有2molH-O键形成,只能说明反应正向进行,不能说明正逆反应速率相等,此时的状态不一定平衡,故A正确;
B.CH3OH的浓度不再改变的状态是平衡状态的特征,故B错误;
C.容器中气体的平均摩尔质量等于质量和物质的量的比值,质量守恒,但是物质的量始终变化,所以当气体的平均摩尔质量不变的状态是平衡状态,故C错误;
D.容器中的反应是在恒压下进行的,当容器中气体的压强不变时,不一定是平衡状态,故D正确.
故选AD.
点评 本题涉及化学平衡的判断以及热化学方程式的焓变的计算等知识,注意盖斯定律的应用是关键,难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:多选题
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
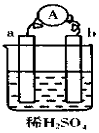
| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,外电路中,电流从b极到a极 | |
| D. | a极上发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: | |
| B. | 乙烯的比例模型: | |
| C. | 乙醛的结构简式:CH3COH | |
| D. | 含中子数为10的氧元素的一种核素${\;}_8^{18}O$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 次氯酸的电子式: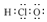 | B. | S2-的结构示意图: | ||
| C. | O-18的原子符号:${\;}_{\;}^{15}$O | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
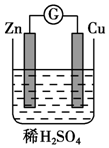 将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题:
将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com