
| A. | 电解氧化铝获得铝 | B. | 戴维发现金属钠 | ||
| C. | 青铜器时代 | D. | 锌铸币的出现 |
科目:高中化学 来源: 题型:选择题
 如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )
如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )| A. | 生石灰 | B. | 食盐 | C. | 蔗糖 | D. | 固体NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:④>②>③>① | B. | 原子半径:④>③>②>① | ||
| C. | 电负性:④>③>①>② | D. | 最高正化合价:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
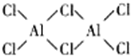

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯酸钾溶液中加入硝酸银溶液和稀硝酸,检验氯酸钾中的氯元素 | |
| B. | 铜可溶于浓硫酸却不溶于稀硫酸,证明浓硫酸的氧化性更强 | |
| C. | 氢氧化铝能分别跟强酸和强碱反应,说明氢氧化铝是两性氢氧化物 | |
| D. | 通过测溶液的pH,鉴别NH4Cl、NaCl、K2CO3三种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 稳定性:HCl>H2S>PH3 | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 还原性:F->CI->Br - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 硝酸钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | X | Y | Z | W | M | Q |
| 原子半径/nm | 0.037 | 0.074 | 0.099 | 0.186 | 0.102 | 0.143 |
| 主要化合价 | +1 | -2 | -1、+7 | +1 | -2、+6 | +3 |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com