
| A. | 溶液中只含Cu2+、Fe2+、Fe3+ | B. | 溶液呈蓝色 | ||
| C. | 无固体析出 | D. | 发生了置换反应 |
分析 FeCl3具有氧化性,可与铜发生氧化还原反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3═2FeCl2+CuCl2,
解答 解:FeCl3具有氧化性,可与铜发生氧化还原反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3═2FeCl2+CuCl2,
A.溶液中发生的反应只有Cu+2FeCl3═2FeCl2+CuCl2,水溶液中存在的离子为:Cu2+、Fe2+、Fe3+、H+、OH-,故A错误;
B.溶液中亚铁离子为浅绿色溶液、铁离子为黄色溶液、铜离子溶液为蓝色,所以溶液不是蓝色,故B错误;
C.溶液中发生的反应只有Cu+2FeCl3═2FeCl2+CuCl2,无固体析出,故C正确;
D.溶液中发生的反应只有Cu+2FeCl3═2FeCl2+CuCl2,不是置换反应,故D错误;
故选C.
点评 本题考查了铁离子的氧化性分析,主要是过量氯化铁和铜发生的反应产物判断,掌握基础是解题关键,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:解答题
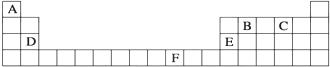
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA | |
| B. | 常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA | |
| C. | 常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH-,0.02NA | |
| D. | 1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.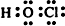 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是七个基本物理量之一 | |
| B. | 阿伏加德罗常数就是6.02×1023mol-1 | |
| C. | 1mol氢的质量是2g | |
| D. | 1个甲烷分子的质量是2.66×10-23g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,14g CO和N2的混合物含的原子数为NA | |
| B. | 1mol Fe发生氧化反应失去的电子数一定是3NA | |
| C. | 0.1mol•L-1 NaCl溶液中含的Cl-数是0.1NA | |
| D. | 0.1mol H2SO4与1L 0.1mol•L-1 NaOH溶液反应,生成的H2O分子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+H2O═4HF+O2 | B. | Si+2NaOH+H2O═Na2SiO3+2H2↑ | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | P2O5+3H2O═2H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaCl、AgNO3 | B. | Na2SO4、NaOH、HCl | ||
| C. | Na2SO4、NaNO3、NaOH | D. | Na2SO4、BaCl2、CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com