
Ϊ��֤��������������ʣ��ס��ҡ����������˷ֱ�ѡ�������Լ�����ʵ�飺0.1 mol·L��1������Һ��0.1 mol·L��1���ᡢpH��3�����ᡢpH��3�Ĵ��ᡢCH3COONa���塢NaCl���塢CH3COONH4���塢����ˮ��п����pH��ֽ����̪��NaOH��Һ�ȡ�
(1)��ȡ��10 mL 0.1 mol·L��1�Ĵ�����Һ����pH��ֽ�����pH��a��ȷ��������������ʣ���aӦ������Ĺ�ϵ��__________________________��
������________________________________________________________________________��
(2)�ҷֱ�ȡpH��3�Ĵ���������1 mL���ֱ�������ˮϡ�͵�100 mL��Ȼ����pH��ֽ�ֱ�ⶨ����Һ��pH������϶�������������ʣ��жϵ�������________________________________________________________________________��
(3)���ֱ�ȡpH��3������ʹ����10 mL��Ȼ�����������ͬ��п��������ų�H2�����ʿ죬���϶�������������ʣ�����Ϊ��һ������ȷ��________����˵�����ɣ�_____________________________��
(4)����CH3COONa���塢NaCl���塢����ˮ�ͷ�̪��ʵ�飬Ҳ��֤�˴������������ʵ����ͬѧ��ʵ�������������______________________��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�� ��5-��������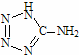 ���м������Ga���õ�������һ���������巢������������������ȫ���ҡ�
���м������Ga���õ�������һ���������巢������������������ȫ���ҡ�
��1����̬Gaԭ�ӵĵ����Ų�ʽ�ɱ�ʾΪ ��
��2��5-��������������Ԫ�صĵ縺���ɴ�С��˳��Ϊ ��
��1mol 5-���������к��еĦҼ�����ĿΪ ��
��3���������ƣ�NaN3���Ǵ�ͳ����������ȫ������ʹ�õ����巢������
�ٵ������ƣ�NaN3���к��е���������ӣ�N3-�������ݵȵ�����ԭ��N3-�Ŀռ乹��Ϊ ���������Ȼ��ѡ�̼���ơ�����������ԭ�ϣ���������̼�����ѻ������ṹ����̼ԭ��ȡ�������Ѿ������ṹ����ͼʾ������ĵ�ԭ�ӣ�����̼�����ѻ�����Ļ�ѧʽΪ ��
������ͬ���ڵ�����Ԫ�صĻ�̬ԭ���У�δ�ɶԵ�����������ͬ��Ԫ���� ������дԪ�ط��ţ�
�� [Ti(OH)2(H2O)4]2+�еĻ�ѧ���� ��
A���Ҽ� B���м� C�����Ӽ� D����λ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ������п����V mLŨ��Ϊ10%��ϡ���ᷴӦ��ȡ����������Ӧ������м����������ʣ����ڷ�Ӧ����v˵����ȷ����(����)
A������Na2SO4���壬v(H2)��С
B��V mL BaCl2��Һ��v(H2)����
C������ϸС��̼����v(H2)����
D������NH4HSO4���壬v(H2)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
H2CO3�ĵ���ƽ�ⳣ��Ka1��4.3��10��7��Ka2��5.6��10��11������Ka1��Ka2���ܴ��ԭ��(�ӵ���ƽ��ĽǶȽ���)��_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ˮϡ�ͣ�����ͼ�л���pHֵ�ı仯ͼ��
��ˮϡ����ͬ�ı�����________��pH��
��ˮϡ�͵���ͬ��pHֵ��________�����ˮ�ࡣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������0.1 mol·L��1������Һ��pH��a��������ʹ��ҺpH��(a��1)�Ĵ�ʩ��(����)
A������Һϡ�͵�ԭ�����10��
B�����������Ĵ����ƹ���
C����������0.2 mol·L��1����
D�������Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25 ��ʱ��������������Һ��
| �� | �� | �� | �� |
| 0.1 mol·L��1��ˮ | pH��11��ˮ | 0.1 mol·L��1���� | pH��3���� |
����˵������ȷ����(����)
A����ϡ�͵�ԭ����100����pH�����ͬ
B��������٢ۻ�ϡ�������ڢܻ�����õ���Һ��������
C���٢��зֱ��������CH3COONa���壬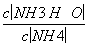 ��ֵ����С
��ֵ����С
D���ۢ�ϡ�͵�ԭ����100����ϡ�ͺ����Һ�е�pH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������Ҫ�ɷ�ΪFeTiO3���ɱ�ʾΪFeO��TiO2������������MgO��SiO2�����ʡ������������Ʊ��������ѣ���һ���Ʊ��ѵ���,������ͼ��
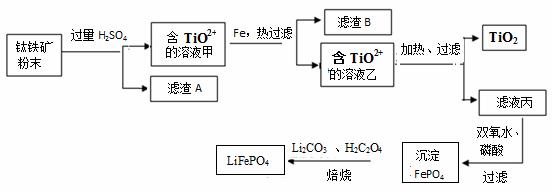
��֪��FeTiO3��4H+��Fe2+��TiO2+��2H2O
���ᣨC2H2O4�����к�ǿ��ԭ�ԣ��ױ������ɶ�����̼
��1��������FeTiO3����Ԫ�صĻ��ϼ��� ��
��2��������������H2SO4�õ�������AΪ_______________���ѧʽ����
��3����TiO2+ ��Һ��ת������TiO2�����ӷ���ʽ�� ��
��4������Һ���Ʊ�LiFePO4�Ĺ����У�����17%˫��ˮ��H2C2O4���������� ��
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��ָʾ������NH4Fe��SO4��2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������w g������c mol/L NH4Fe��SO4��2����ҺVmL����TiO2��������Ϊ ���ô���ʽ��ʾ����

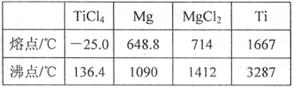 ��6��TiO2��ȡ����Ti���漰���IJ������£�
��6��TiO2��ȡ����Ti���漰���IJ������£�
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
��Ӧ�ڵķ���ʽ�� �� ��TiCl4��Ti��Ҫ��Ar���н��е������� ����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�����ݱ�����Ϣ������ȵ��¶��Ը��� �漴�ɡ�
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��20 L���ܱ������а����ʵ���֮��Ϊ1��2����CO��H2��������CO(g)��2H2(g)CH3OH(g)����H�����CO��ת�������¶ȼ���ͬѹǿ�µı仯��ͼ��ʾ��p2��195 ��ʱn(H2)��ʱ��ı仯��������ʾ������˵����ȷ����(����)
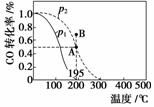
p2��195 �� n(H2)��ʱ��仯
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
A.p1��p2����H��0
B����p2��195 ��ʱ����Ӧǰ3 min��ƽ������v(CH3OH)��0.8 mol��L��1��min��1
C����p2��195 ��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ25
D����B��ʱ��v����v��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com