
【题目】常温下,以MnO2为原料制得的MnCl2溶液中常合有Cu2+、Pb2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2++S2-→CuS↓
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其反应的离子方程式为___。
(2)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为___,反应过程分两步,其中第2步反应的化学方程式为___。
(3)写出溶液中硫酸氢钠的电离方程式___。
(4)配制某浓度的稀硫酸,用10mL量筒量取浓硫酸的体积如图Ⅰ所示,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中浓硫酸的体积是___mL。

(5)要用CuSO4·5H2O晶体配制500mL0.01mol/LCuSO4溶液,应该用托盘天平称取CuSO4·5H2O___g(读到小数点后两位)
(6)图Ⅱ所示仪器的名称是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用下图装置研究原电池的工作原理。
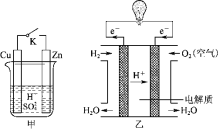
(1)甲中K断开时,装置中发生反应的离子方程式为_______________________;K闭合时,Cu棒上的现象为________,它为原电池的________(填“正”或“负”)极。
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的________(填“正”或“负”)极,发生________(填“氧化”或“还原”)反应。
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。完成下列填空:
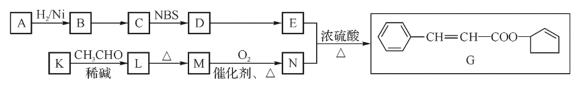
已知:A的分子式为![]() ,它有两种不同环境的氢原子,K的分子式为
,它有两种不同环境的氢原子,K的分子式为![]() 。
。
![]() (提示:碳碳双键直接相邻的氢被
(提示:碳碳双键直接相邻的氢被![]() 取代)
取代)
![]()
![]()
(1)写出反应类型:![]() _____;写出反应试剂及条件:
_____;写出反应试剂及条件:![]() ___。
___。
(2)书写结构简式:A___。写出化学方程式:![]() _______。
_______。
(3)检验M已完全转化为N的试剂是__________。
(4)写出满足下列条件的L的任意一种同分异构体的结构简式(不考虑立体异构):_____。①能发生银镜反应 ②能发生水解反应 ③苯环上的一氯代物有两种
(5)以1-丁醇和NBS为原料可以制备顺丁橡胶(![]() )。请设计合成路线(其他无机原料任选)(合成路线常用的表示方式为:A
)。请设计合成路线(其他无机原料任选)(合成路线常用的表示方式为:A ![]() B。。。
B。。。![]() 目标产物)_____
目标产物)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备CuO。
(1)Cu2+基态核外电子排布式为________。
(2)SO42-的空间构型为_______(用文字描述)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为______;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
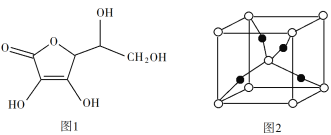
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某硏究小组为硏究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
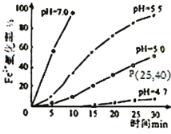
回答下列问题:
(1)写出Fe2+水解的离子方程式___;要抑制FeSO4水解,可以采取的措施是___。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率___。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+![]() 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响___。
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是___。
(6)用K2Cr2O7标准溶液測定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L-1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+![]() O2(g)=CO2(g);△H=-283kJ/mol,Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g)=CO2(g);△H=-283kJ/mol,Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g);△H=-226kJ/mol,根据以上热化学方程式判断,下列说法正确的是
O2(g);△H=-226kJ/mol,根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系

C.Na2O2(s)与CO2(g)反应放出226kJ热量时,电子转移数为2NA
D.Na2O2(s)+CO(g)=Na2CO3(s);△H=-509kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) △H<0。下列结论中正确的是
pC(g)+qD(g) △H<0。下列结论中正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的1.8倍,则m+n<p+q
B.反应达平衡时,A、B的转化率一定相等
C.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol
D.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中_____与盐酸反应最剧烈,_____与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________________。
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
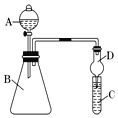
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________的现象,即可证明。干燥管D的作用是_________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_____溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量_____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com