
废旧锂离子电池的正极材料(主要含有 及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
及少量Al、Fe等)可用于回收钴、锂,实验方法如下:

已知:Fe3+开始沉淀pH=2.7, 完全沉淀pH=3.2; Al3+开始沉淀pH=3.8, 完全沉淀pH=5.2; Co2+完全沉淀pH=9.15
(1)在上述溶解过程中, 被氧化成
被氧化成 ,
, 在溶解过程中反应的化学方程式为 ,氧化剂是__________。
在溶解过程中反应的化学方程式为 ,氧化剂是__________。
(2)在上述除杂过程中,通入空气的作用是_____________________。通入空气和加入NaOH溶液后发生的离子方程式和______________ 废渣的主要成分是Al (OH)3和_______________。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为_________________________________、______________________________________。
(4)该工艺可回收的副产品是_________________________(写化学式)。
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:

①写出该反应的热化学方程式: _ 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ 。
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
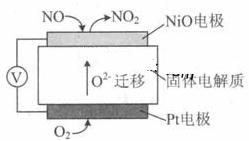
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和水蒸气在高温条件下发生反应3Fe+4H2O(g)  Fe3O4+4H2 ,在此反应中水是( )
Fe3O4+4H2 ,在此反应中水是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,乙烷和乙烯都能制备氯乙烷(C2H5Cl)。试回答:
(1)用乙烷制备氯乙烷的化学方程式是
____________________________________________,该反应的类型是________________;
(2)用乙烯制备氯乙烷的化学方程式是_______________________,该反应的类型是________;
(3)上述两种制备氯乙烷的方法中,________方 法好。原因是__________________________________。
法好。原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、A lCl3、MgCl2、Na2SO4四种溶液
lCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单质。Z为品红溶液。实验中观察到Z褪色。则Y为
A.Na B.Mg C.Al D.Mg或Al

查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)  2HCl(g)+Q1
2HCl(g)+Q1
H2(g)+Br2(g)  2HBr(g)+Q2
2HBr(g)+Q2
有关上述反应的叙述正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排序不正确的是( )
A.熔点:CF4 < CCl4 B.熔点: K > Na
C.硬度: 金刚石 > 碳化硅 D.晶格能: Na > NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com