
【题目】信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
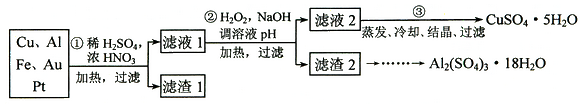
(1) 第①步Cu与酸反应的离子方程式为 。
(2) 第②步加H2O2的作用是 。
(3) 该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定(原理为I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 滴定过程中可选用________作指示剂,滴定终点的现象是____________。
② CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标
准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+。
③ 写出计算CuSO4·5H2O质量分数的表达式w=___________。
(4)请补充完整从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入_________至滤渣不再溶解,过滤, 在滤液中 、过滤、用水洗涤固体2-3次,在50℃下干燥,得到Al2(SO4)3·18H2O。(可选试剂有:硫酸溶液、氢氧化钠溶液、氨水、二氧化碳)
【答案】(1) Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
(或3Cu+8H++2NO![]() ===3Cu2++2NO↑+4H2O)(2分)
===3Cu2++2NO↑+4H2O)(2分)
(2) 将Fe2+氧化成Fe3+(1分)
(3) ① 淀粉溶液(1分) 蓝色刚好褪去,且半分钟内不恢复蓝色(1分)
② 2Cu2++4I-===2CuI↓+I2(2分)
③ 7.5c/a×100%(3分) ④ 氢氧化钠溶液(1分)通人二氧化碳至不再有沉淀析出,过滤、用水洗涤固体2-3次,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶
【解析】
试题分析:(1)Cu和浓HNO3的离子反应为:Cu+4H++2NO3- ═ Cu2++2NO2↑+2H2O;(2)双氧水作氧化剂把Fe2+氧化为Fe3+;(3)①有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法,要求蓝色刚好褪去,且半分钟内不恢复蓝色;②铜离子被I-还原为亚铜离子,碘离子被氧化为I2,根据原子守恒和得失电子守恒书写离子方程式为2Cu2++4I- ═2CuI↓+I2;③根据方程式可知20.00mL溶液中n(CuSO4![]() 5H2O) = n(EDTA) = c × 6 × 10-3mol;所以m(CuSO4
5H2O) = n(EDTA) = c × 6 × 10-3mol;所以m(CuSO4![]() 5H2O) = c × 6 × 10-3 mol × 250 g/mol =1 .5c g,因此100mL溶液中CuSO4
5H2O) = c × 6 × 10-3 mol × 250 g/mol =1 .5c g,因此100mL溶液中CuSO4![]() 5H2O的质量为:1.5c×5=7.5cg,所以w=
5H2O的质量为:1.5c×5=7.5cg,所以w=![]() ×100%;④从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入过量 氢氧化钠溶液,铝元素生成偏铝酸钠溶液,再通人二氧化碳生成氢氧化铝沉淀至不再有沉淀析出,过滤、用水洗涤固体2-3次,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶。
×100%;④从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入过量 氢氧化钠溶液,铝元素生成偏铝酸钠溶液,再通人二氧化碳生成氢氧化铝沉淀至不再有沉淀析出,过滤、用水洗涤固体2-3次,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.W2-、X+ B.X+、 Y3+
C.Y3+、 Z2- D.X+、 Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 镁带燃烧可以用CO2灭火
B. 单晶硅是重要的半导体材料,常用于制造光导纤维
C. Cl2能使湿润的有色布条褪色,是因为Cl2的氧化性
D. 金属钠可保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶标签上的有关信息,试根据标签上的有关数据,回答下列问题(一)(二):(计算结果保留一位小数)

(一).(1)浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2) 量取___ ____mL浓盐酸加水稀释就得到500 mL、0.4mol·L-1的稀盐酸。
(二).取该浓盐酸10g与某MgCl2溶液90g混合,向混合溶液中逐滴加入10%的NaOH溶液,生成的沉淀的质量与加入的NaOH溶液质量关系如下图所示。

回答下列问题
(1)A点溶液的溶质化学式为 。
(2)与MgCl2反应的溶质氢氧化钠的质量为 g。
(3)恰好沉淀完全时,C点所得溶液中溶质的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质,A是红色固体,B是黑色固体,各物质间的转化关系如下图,根据推断写出下列物质的化学式:A. ,B. ,C. ,D. 。
写出C生成D的化学方程式 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是( )
A. Zn为电池的负极
B. 正极反应式为:2FeO42-+ 10H++6e- =Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度不变
D. 电池工作时OH- 向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
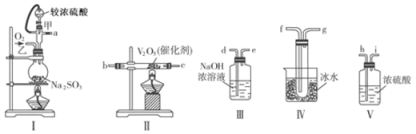
(1)写出I中用70%的硫酸和亚硫酸钠制取二氧化硫的化学方程式 。
(2)这些装置的连接顺序(按气体从左到右的方向)是a→ → → → → → → →d(填各接口的编号)。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。II中发生的化学方程式为 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 。(填“填大”“不变”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里有四个药品橱,已经存放以下列试剂:
药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
药品 | 醋酸、乙醇、苯 | 明矾、CuSO45H2O、MgCl2 | 白磷、硫黄、碳 | 镁条、锌粒、铜 |
实验室新购进一些碘化钾,应该将这些碘化钾放在( )
A. 甲橱 B. 乙橱 C. 丙橱 D. 丁橱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com