
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
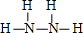
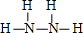
查看答案和解析>>
科目:高中化学 来源: 题型:
由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
![]() N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量 。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)(1)室温下,将1g苯(C6H6)完全燃烧生成液态水和CO2,放出41.8kJ的热量,写出C6H6燃烧的热化学方程式 。
(2)今有两个氢气燃烧生成水的热化学方程式
H2(g)+1/2O2(g) ==H2O(g) △H=a kJ/mol
2H2(g)+O2(g) ==2H2O(l) △H=b kJ/mol
请回答下列问题:(提示:b表示b的绝对值)
①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)bkJ
②反应热的关系:2a b(填“>”、“<”或“=”)。
③ 若已知H2(g)+1/2O2(g) ==H2O(g) △H=―242 kJ/mol ,且氧气中1mol氧氧键完全断裂时吸收热量496kJ,水蒸气中1molH―O键形成时放出热量463kJ,则氢气中1molH―H键断裂时吸收的热量为查看答案和解析>>
科目:高中化学 来源: 题型:
(1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,1g水蒸气转化成液态水放热2.5 kJ,则反应2H2(g)+ O2(g) = 2H2O(l)的△H=_______________,氢气的燃烧热为_______________。
(2)在火箭推进器中装有还原剂液态肼(N2H4)和强氧化剂液态H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知一些键断裂所需能量数据:
N-N:159 kJ /mol N=N:419 kJ /mol N≡N:945 kJ /mol H-H:436 kJ /mol
N-H:389 kJ /mol H-O:465 kJ /mol O-O:138 kJ /mol O=O:498 kJ /mol
①写出肼和过氧化氢的结构式:肼______ ___,过氧化氢______
②写出肼和双氧水反应的热化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 相同物质的量的O2和O3,所含分子数目之比为_________,所含O的物质的量之比为_________。
(2) 在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,含原子数最多的是______,体积最小的是_______。
(3) 标况下,将224L的HCl气体溶于835ml(ρ=1g/cm3)的水中,所得盐酸的密度为1.2g/cm3, 该盐酸的物质的量浓度___________
(4) 某气体物质质量为6.4 g,含有6.02×1022个分子,则该气体的相对分子质量为__________
(5)Na2CO3的摩尔质量是____________,0.5mol Na2CO3的质量是____________,含有________mol Na+, ______mol CO3 2-,Na+的个数约为___________;若将其溶于水,配成250mL的溶液,则该溶液溶质的物质的量浓度为_____________;若向溶液中加入过量的稀盐酸,产生的气体体积为(标况下)__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com