
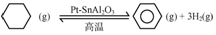
分析 (1)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,H元素化合价由-1价、+1价变为0价,再结合转移电子守恒配平方程式,根据NaBH4和转移电子之间的关系式计算;
(2)根据化学平衡常数K=$\frac{c(C{\;}_{6}H{\;}_{6}).c{\;}^{3}(H{\;}_{2})}{c(C{\;}_{6}H{\;}_{12})}$计算;
解答 解:(1)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,NaBO2中B元素化合价为+3价,所以NaBH4中H元素的化合价为-1价,所以H元素化合价由-1价、+1价变为0价,再结合转移电子守恒配平方程式为NaBH4+2H2O=NaBO2+4H2↑,反应消耗1mol NaBH4时转移的物质的量=1mol×4×(1-0)=4mol,所以转移电子数为4NA或2.408×1024,故答案为:NaBH4+2H2O=NaBO2+4H2↑;4NA或2.408×1024;
(2)环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=$\frac{c(C{\;}_{6}H{\;}_{6}).c{\;}^{3}(H{\;}_{2})}{c(C{\;}_{6}H{\;}_{12})}$=$\frac{b×(3b){\;}^{3}}{(a-b)}$=$\frac{27b{\;}^{4}}{a-b}$,
故答案为:$\frac{27b{\;}^{4}}{a-b}$.
点评 本题考查了方程式的书写、转移电子数的计算以及化学平衡常数计算等,根据氧化还原反应原理和化学平衡常数表达式来分析解答,难度不大.


科目:高中化学 来源: 题型:选择题
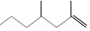 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),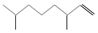 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )| A. | 2,4-二甲基1庚烯的分子式为C9H18 | |
| B. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| C. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| D. | 1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~E是核电荷数均小于20的元素,其结构或性质信息如下表
A~E是核电荷数均小于20的元素,其结构或性质信息如下表| 元素 | A | B | C | D | E |
| 性质或结构信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
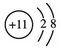 ,B原子的电子式:
,B原子的电子式: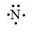 ,E离子的电子式:
,E离子的电子式: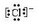 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol氧化剂反应则还原剂失电子的物质的量为5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol•L-1NaCl溶液 | B. | 75mL1mol•L-1CaCl2溶液 | ||
| C. | 150mL1mol•L-1KCl溶液 | D. | 75mL1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中,Ag+、K+、NO3?、Mg2+可以大量共存 | |
| B. | 该溶液中,H+、NH4+、SO42?、I?可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023 | |
| D. | 向该溶液中滴入少量Na2SO3溶液,反应的离子方程式为:SO32?+ClO?═Cl?+SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.1 mol/(L•min) | B. | v (N2)=0.6 mol/(L•min) | ||
| C. | v (N2)=0.02mol/(L•s) | D. | v (H2)=0.3 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com