
µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄŅ»ÖÖŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£¬
£Ø1£©ČēĶ¼ŹĒN2£Øg£©ŗĶH2£Øg£©·“Ӧɜ³É1mol NH3£Øg£©¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öN2ŗĶH2·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ””””£»
£Ø2£©ČōŅŃÖŖĻĀĮŠŹż¾Ż£ŗ
| »Æѧ¼ü | H﹣H | N”ŌN |
| ¼üÄÜ/kJ•mol﹣1 | 435 | 943 |
ŹŌøł¾Ż±ķÖŠ¼°Ķ¼ÖŠŹż¾Ż¼ĘĖćN﹣HµÄ¼üÄÜ””””kJ•mol﹣1
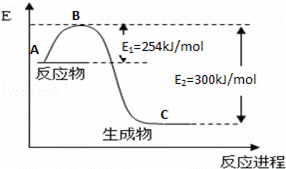
£Ø3£©ŗĻ³É°±·“Ó¦Ķس£ÓĆĢś“„Ć½×÷“߻ƼĮ£®Ź¹ÓĆĢś“„Ć½ŗóE1ŗĶE2µÄ±ä»ÆŹĒ£ŗE1””””£¬E2””£ØĢī”°Ōö“ó”±”¢”°¼õŠ””¢”±”°²»±ä”±£©£®
£Ø4£©ÓĆNH3“߻ƻ¹ŌNOX»¹æÉŅŌĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾£®ĄżČē
4NH3£Øg£©+3O2£Øg£©=2N2£Øg£©+6H2O£Øg£©£»”÷H1=akJ/mol
N2£Øg£©+O2£Øg£©=2NO£Øg£©£»”÷H2=bkJ/mol
Čō1mol NH3»¹ŌNOÖĮN2£¬ŌņøĆ·“Ó¦¹ż³ĢÖŠµÄ·“Ó¦ČČ”÷H3=””””kJ/mol£ØÓĆŗ¬a”¢bµÄŹ½×Ó±ķŹ¾£©
| ·“Ó¦ČČŗĶģŹ±ä£»»ÆѧÄÜÓėČČÄܵÄĻą»„×Ŗ»Æ£® | |
| ×ØĢā£ŗ | »Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ£® |
| ·ÖĪö£ŗ | £Ø1£©ĻČĒó³ö“Ė·“Ó¦µÄģŹ±ä£¬øł¾ŻČČ»Æѧ·½³ĢŹ½µÄŹéŠ“¹ęŌņŌŁŠ“³öČČ»Æѧ·½³ĢŹ½£» £Ø2£©øł¾Ż·“Ó¦ČȵČÓŚ·“Ó¦ĪļµÄ×ܼüÄܼõČ„Éś³ÉĪļµÄ×ܼüÄܼĘĖć£» £Ø3£©¼ÓČė“߻ƼĮ£¬·“Ó¦ĪļŗĶÉś³ÉĪļµÄ»ī»ÆÄܶ¼½µµĶ£» £Ø4£©ĄūÓĆøĒĖ¹¶ØĀɼĘĖć£® |
| ½ā“š£ŗ | ½ā£ŗ£Ø1£©·“Ó¦Īļ×ÜÄÜĮæ“óÓŚÉś³ÉĪļ×ÜÄÜĮ棬ӦĪŖ·ÅČČ·“Ó¦£¬Éś³É1mol°±Ęų·Å³ö46kJČČĮ棬Ōņ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖN2£Øg£©+3H2£Øg£©⇌2NH3£Øg£©”÷H=﹣92kJ/mol£¬ ¹Ź“š°øĪŖ£ŗN2£Øg£©+3H2£Øg£©⇌2NH3£Øg£©”÷H=﹣92kJ/mol£» £Ø2£©·“Ó¦ČȵČÓŚ·“Ó¦ĪļµÄ×ܼüÄܼõČ„Éś³ÉĪļµÄ×ܼüÄÜ£¬ÉčN﹣HµÄ¼üÄÜĪŖx£¬ Ōņ943+3”Į435﹣6x=﹣92£¬x=390£¬¹Ź“š°øĪŖ£ŗ390£» £Ø3£©¼ÓČė“߻ƼĮ£¬·“Ó¦ĪļŗĶÉś³ÉĪļµÄ»ī»ÆÄܶ¼½µµĶ£¬¹Ź“š°øĪŖ£ŗ¼õŠ”£»¼õŠ”£» £Ø4£©ŅŃÖŖ¢Ł4NH3£Øg£©+3O2£Øg£©=2N2£Øg£©+6H2O£Øg£©£»”÷H1=akJ/mol ¢ŚN2£Øg£©+O2£Øg£©=2NO£Øg£©£»”÷H2=bkJ/mol ĄūÓĆøĒĖ¹¶ØĀɽ« ¹Ź“š°øĪŖ£ŗ |
| µćĘĄ£ŗ | ±¾Ģāæ¼²é×ŪŗĻæ¼²é»Æѧ·“Ó¦ÓėÄÜĮæ±ä»ÆÖŖŹ¶£¬×¢ŅāĪļÖŹµÄ×ÜÄÜĮ攢¼üÄÜÓė·“Ó¦ČČµÄ¼ĘĖć¹ŲĻµ£¬°ŃĪÕøĒĖ¹¶ØĀɵļĘĖć·½·Ø£¬ĢāÄæÄѶČÖŠµČ£® |
””


 Ó„ÅɽĢøØĻĪ½Ó½Ģ²ÄŗÓ±±½ĢÓż³ö°ęÉēĻµĮŠ“š°ø
Ó„ÅɽĢøØĻĪ½Ó½Ģ²ÄŗÓ±±½ĢÓż³ö°ęÉēĻµĮŠ“š°ø ³õÖŠŹīĘŚĻĪ½ÓĻµĮŠ“š°ø
³õÖŠŹīĘŚĻĪ½ÓĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĪļÖŹŹōÓŚ·Ēµē½āÖŹ£¬µ«ĘäĖ®ČÜŅŗÄܵ¼µēµÄŹĒ£Ø””””£©
| ”” | A£® | Fe | B£® | CH4 | C£® | NH3 | D£® | Ļ”H2SO4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijӊ»śĪļXµÄ·Ö×ÓŹ½ĪŖC3H6O2£®XŌŚĖįŠŌĢõ¼žĻĀÓėĖ®·“Ó¦£¬Éś³ÉµÄÓŠ»śĪļYŗĶZ£®YŌŚĶ“ß»ÆĻĀ±»Ńõ»ÆĪŖW£¬ZŗĶWÄÜ·¢ÉśŅų¾µ·“Ó¦£®
£Ø1£©XŗĶZµÄĆū³ĘĪŖ£ŗX””””£¬Z””””£®
£Ø2£©Š“³öĻĀĮŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
YÓėÅØĮņĖįµÄ»ģŗĻĪļ¹²ČČ·¢ÉśĻūČ„·“Ó¦””””£¬WÓėŠĀÖĘCu£ØOH£©2”¢NaOH»ģŗĻČÜŅŗ¹²ČČ·¢ÉśµÄ·“Ó¦””””£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
°ŃŌŚæÕĘųÖŠ¾ĆÖƵÄĀĮʬ5.0gĶ¶ČėŹ¢ÓŠ 500mL 0.5mol•L﹣1ĮņĖįČÜŅŗµÄÉÕ±ÖŠ£¬øĆĀĮʬÓėĮņĖį·“Ó¦²śÉśĒāĘųµÄĖŁĀŹvÓė·“Ó¦Ź±¼ätæÉÓĆČēĶ¼µÄ×ų±źĒśĻߥ“±ķŹ¾£¬ĻĀĮŠĶĘĀŪ“ķĪóµÄŹĒ£Ø””””£©
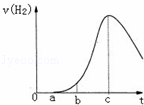
| ”” | A£® | tÓÉ0”śa¶Ī²»²śÉśĒāĘųŹĒŅņĪŖ±ķĆęµÄŃõ»ÆĪļøōĄėĮĖĀĮŗĶĮņĖįČÜŅŗ |
| ”” | B£® | tÓÉb”śc¶Ī²śÉśĒāĘųµÄĖŁĀŹŌö¼Ó½ĻæģµÄÖ÷ŅŖŌŅņÖ®Ņ»ŹĒĪĀ¶ČÉżøß |
| ”” | C£® | t£¾c²śÉśĒāĘųµÄĖŁĀŹ½µµĶÖ÷ŅŖŹĒŅņĪŖČÜŅŗÖŠc£ØH+£©½µµĶ |
| ”” | D£® | t=cŹ±·“Ó¦“¦Ę½ŗāדĢ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ČēĶ¼ŹĒĀČ¼ī¹¤ŅµÖŠÓ¦ÓƵÄĮ¢Ź½øōĤµē½ā²ŪŹ¾ŅāĶ¼£¬ĘäÖŠµÄĄė×ÓĤ½öŌŹŠķŃōĄė×ÓĶعż£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
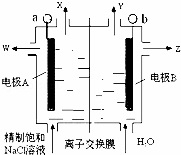
| ”” | A£® | ¼ÓČėµÄH2OæÉÓĆĻ”NaClČÜŅŗ“śĢę£¬ŅŌŌö¼Óµ¼µēÄÜĮ¦ |
| ”” | B£® | WŹĒĻ”µÄĀČ»ÆÄĘČÜŅŗ |
| ”” | C£® | OH﹣“ÓŅõ¼«ĒųĻņŃō¼«ĒųŅĘ¶Æ |
| ”” | D£® | bµē¼«·“Ó¦Ź½£ŗ2Cl﹣﹣2e﹣=Cl2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¾Ż±ØµĄ£¬ĪŅ¹śÓµÓŠĶźČ«×ŌÖ÷²śČصÄĒāŃõČ¼ĮĻµē³Ų³µŅŃ¾ŌŚ°ĀŌĖ»įĘŚ¼äĪŖŌĖ¶ÆŌ±Ģį¹©·žĪń”£Ä³ÖÖĒāŃõČ¼ĮĻµē³ŲµÄµē½āŅŗĪŖKOHČÜŅŗ”£ĻĀĮŠÓŠ¹Ųµē³ŲµÄŠšŹö²»ÕżČ·µÄŹĒ( )
A.øŗ¼«·“Ó¦Ź½ĪŖ2H2+4OH--4e-====4H2O
B.¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬵ē½āŅŗÖŠµÄKOHµÄĪļÖŹµÄĮæ²»±ä
C.øĆČ¼ĮĻµē³ŲµÄ×Ü·“Ó¦·½³ĢŹ½ĪŖ£ŗ2H2+O2====2H2O
D.ÓĆøƵē³Ųµē½āCuCl2ČÜŅŗ£¬²śÉś2.24 L Cl2(±ź×¼×“æö)Ź±£¬ÓŠ0.1 molµē×Ó×ŖŅĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ņ»ÖÖ¹ā»Æѧµē³ŲµÄ½į¹¹ČēĶ¼ĖłŹ¾,µē³Ų×Ü·“Ó¦ĪŖAgCl(s)+
Cu+(aq)====Ag(s)+Cu2+(aq)+Cl-(aq),ĻĀĮŠ¹ŲÓŚøƵē³ŲŌŚ¹¤×÷Ź±µÄĖµ·ØÖŠÕżČ·µÄŹĒ””(””””)
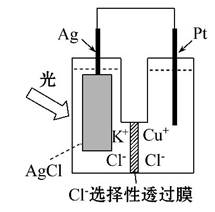
A.Cl-ÓÉøŗ¼«ĒØŅʵ½Õż¼«
B.øŗ¼«ÉĻĪļÖŹ·¢Éś»¹Ō·“Ó¦
C.Cu+ŌŚøŗ¼«·¢ÉśŃõ»Æ·“Ó¦
D.Éś³É108 gŅų,×ŖŅʵē×ÓøöŹżĪŖ1 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
N2+3H2 2NH3ŹĒÄæĒ°¹¤ŅµÉĻŗĻ³É°±µÄ·“Ó¦£¬ĻĀĮŠ¹ŲÓŚøĆ·“Ó¦µÄĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
2NH3ŹĒÄæĒ°¹¤ŅµÉĻŗĻ³É°±µÄ·“Ó¦£¬ĻĀĮŠ¹ŲÓŚøĆ·“Ó¦µÄĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
| ”” | A£® | Ōö¼ÓN2µÄÅضČÄܼÓæģ·“Ó¦ĖŁĀŹ |
| ”” | B£® | ½µµĶĢåĻµĪĀ¶ČÄܼÓæģ·“Ó¦ĖŁĀŹ |
| ”” | C£® | Ź¹ÓĆ“ß»Æ¼Į²»Ó°Ļģ·“Ó¦ĖŁĀŹ |
| ”” | D£® | Čō·“Ó¦ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬N2ŗĶH2ÄÜ100%×Ŗ»ÆĪŖNH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ä³ŃŠ¾æŠ”×éŌŚŹµŃéŹŅÓĆČż·Ż²»Ķ¬³õŹ¼ÅØ¶ČµÄ°±»ł¼×Ėįļ§(NH2COONH4)ČÜŅŗŌŚ²»Ķ¬ĪĀ¶ČĻĀ½ųŠŠĖ®½āŹµŃé£ŗNH2COONH4+2H2O NH4HCO3+
NH4HCO3+
NH3”¤H2O£¬²āµĆc(NH2COO-)Óė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£¾ŻĶ¼ÅŠ¶ĻĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ ( )
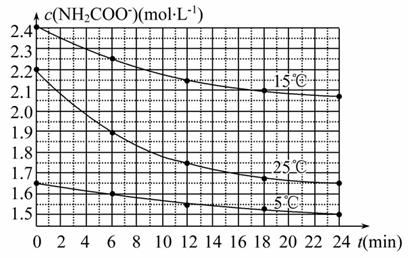
A.0”«12 min£¬³õŹ¼ÅضČŌ½“óµÄŹµŃ飬Ė®½ā·“Ó¦ĖŁĀŹŌ½“ó
B.c(NH2COO-)½«Ėę·“Ó¦Ź±¼äµÄ²»¶ĻŃÓ³¤¶ų²»¶Ļ¼õŠ”
C.25 ”ꏱ£¬0”«6 min£¬v(NH2COO-)ĪŖ0.05 mol”¤L-1”¤min-1
D.15 ”ꏱ£¬µŚ30 minŹ±£¬c(NH2COO-)ĪŖ2.0 mol”¤L-1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com