
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
分析 (1)通过①×2+②+③得方程式:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),依据盖斯定律计算反应热,书写热化学方程式;
(2)提高转化率,需使平衡向正向移动,利用勒夏特列原理结合平衡移动原理分析解答;
(3)利用K与Qc的相对大小判断反应进行的方向,判断正逆反应速率大小;用三段式计算平衡时各物质的浓度.
解答 解:(1)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=-90.8kJ•mol-1×2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1;
故答案为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol;
(2)A.升高温度平衡向逆反应方向移动,转化率减小,故A错误;
B.催化剂不影响平衡移动,但不能提高CO的转化率,故B错误;
C.减少CO2的浓度,平衡正向移动,CO的转化率提高,故C正确;
D.增加CO的浓度,反应速率增大,平衡向正反应移动,但CO的转化率减小,故D错误;
e.分离出二甲醚,平衡向正反应反应移动,但反应速率减慢,故e错误;
故选CE;
此时的Qc=$\frac{c(C{O}_{2})×c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.6×0.6}{0.44{\;}^{2}}$=1.86<K=400,故未达到平衡,反应向正向进行,v(正)>v(逆);
将上表中的浓度可知,CH3OH的起始浓度为0.44+0.6×2=1.64,设CH3OCH3的浓度增大了x,则有
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始(mol/L) 1.64 0 0
转化(mol/L) 2x x x
平衡(mol/L)1.64-2x x x
K═$\frac{c(C{O}_{2})×c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$=$\frac{{x}^{2}}{(1.64-2x){\;}^{2}}$=400,解得x=0.80mol/L,
故答案为:>;0.80mol/L.
点评 本题考查了反应热的计算,化学平衡理论及有关化学平衡常数的计算,明确盖斯定律计算反应热的方法,熟悉化学平衡理论是解题关键,注意平衡常数随温度变化,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在电解池中,物质在阴极发生氧化反应 | |
| B. | 在电解池中,与电源正极相连的电极是阴极 | |
| C. | 在原电池中,物质在负极发生氧化反应 | |
| D. | 在原电池中,电子由正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Cl-的溶液中肯定不存在Ag+ | |
| B. | AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中逐渐加入KI固体至c(I-)=$\frac{{K}_{sp}(AgI)}{{K}_{sp}(AgCl)}$mol•L-1时,AgCl开始向AgI沉淀转化 | |
| D. | 向浓度均为0.01 mol•L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度时,两种饱和溶液中:c(Cl-)≈1.9c(Br-) | |
| B. | AgCl、AgBr组成的混合溶液中:c(Cl-)>c(Br-) | |
| C. | 向饱和AgCl溶液中通入HCl后有沉淀生成,但溶液中c(Cl-)增大 | |
| D. | AgBr在水中溶解度及Ksp均比在NaBr溶液中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
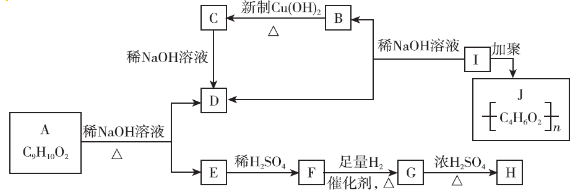
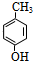 .
.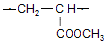 .
.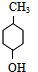 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$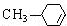 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
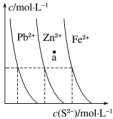 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )| A. | 三种难溶物的溶度积Ksp(FeS)的最小 | |
| B. | 如果向三种沉淀中加盐酸,最先溶解的是PbS | |
| C. | 向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS沉淀 | |
| D. | 对于三种难溶物来讲,a点对应的都是不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性强弱顺序为XO42->Z2>R2>M3+ | |
| B. | Z2在③中发生氧化反应 | |
| C. | R元素在反应②中被氧化,在③中被还原 | |
| D. | 常温下反应不可进行2M2++Z2═2M3++2Z- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com