
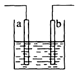
| A. | a、b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硫酸 | |
| C. | 该装置可能是Cu-Ag原电池,电解质溶液为稀硝酸 | |
| D. | 该装置中通过2 mol电子时,溶液质量增加62g |
分析 铜和弱氧化性酸不反应,要使该反应Cu+2H+=Cu2++H2↑发生,则要将该装置设计成电解池,且铜作阳极,电解质为酸或活泼金属的含氧酸盐或可溶性的强碱.
解答 解:铜和弱氧化性酸不反应,要使该反应Cu+2H+=Cu2++H2↑发生,则要将该装置设计成电解池,且铜作阳极,电解质为酸或活泼金属的含氧酸盐或可溶性的强碱.
A.该装置是电解池,a、b材料可能是同种材料,故A正确;
B.该反应不能自发进行,所以只能设计成电解池,电解质溶液为稀硫酸,故B正确;
C.硝酸和铜反应生成氮氧化物而不生成氢气,故C错误;
D.该装置中通过2 mol电子时,溶液质量增加(64-2)=62g,故D正确;
故选C.
点评 本题考查了原电池和电解池原理,根据电池反应式是否自发进行确定为哪种类型的电池,再结合电解池反应来分析解答,知道离子的放电顺序,注意:活泼金属作电解池阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)下列事实不能说明醋酸是弱酸的是①③
(1)下列事实不能说明醋酸是弱酸的是①③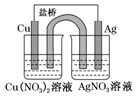 (3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.
(3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═2H2O | B. | HCl+NaOH═NaCl+H2O | ||
| C. | 2HCl+Cu(OH)2═CuCl2+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再变化 | |
| B. | Fe3O4的物质的量不变 | |
| C. | v(H2O)=v(H2) | |
| D. | 断裂4molH-O键的同时,断裂4molH-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 钠和冷水反应:Na+2H2O=Na++OH-+H2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 氢氧化钡溶液与稀硫酸反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2CO3 | |
| D. | (NH4)2SO4 NH4Cl NaNO3 Na2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com