
����Ŀ��ʵ�������ܶ�Ϊ1.18 g��mL-1����������Ϊ36.5%Ũ��������250 mL 0.1 mol��L-1 �����ᣬ��ղ��ش��������⣺
��1������250 mL 0.1 mol��L-1������___________��
Ӧ�����������/mL | Ӧѡ������ƿ�Ĺ��/mL | ����ƿ������������ |
��2������ʱ������ȷ�IJ���˳����(��ĸ��ʾ��ÿ����ĸֻ����һ��)___________��
A.��30 mLˮϴ���ձ��Ͳ�����2��3�Σ�ϴ��Һ��ע������ƿ����
B.����Ͳȷ��ȡ�����Ũ�����������ز����������ձ��У��ټ�������ˮ(Լ30 mL)���ò���������������ʹ���Ͼ���
C.������ȴ�������ز�����ע��250 mL������ƿ��
D.������ƿ�ǽ�����ҡ��
E.���ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�������
F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���1��2 cm��
��3������A�У���ϴ��Һ����������ƿ����Ŀ����___________����Һע������ƿǰ��ָ������£�������Ϊ___________��
��4����ʵ������г������������δ�����������ˮʱ���������˿̶���___________��������ƿ��ת����Һʱ(ʵ�鲽���)������Һ�ε�������ƿ����___________��
���𰸡� 2.1��250����Ͳ���ձ�������������ͷ�ι� B��C��A��F��E��D ��֤����ȫ��ת������ƿ ����ƿʢ������Һʱ�������,Ҳ��������ƿը�� ����ʵ��ʧ�ܣ�ϴ������ƿ���������� ����ʵ��ʧ�ܣ�ϴ������ƿ����������
��������
��1������![]() ��֪Ũ��������ʵ���Ũ��Ϊ1000��1.18��36.5%/36.5 mol/L��11.8 mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ�������ã�V��11.8mol/L=0.1mol/L��250mL�����V=2.1 mL������ʱ������Ҫ250mL����ƿ���⣬����Ҫ��Ͳ���ձ�������������ͷ�ιܣ�
��֪Ũ��������ʵ���Ũ��Ϊ1000��1.18��36.5%/36.5 mol/L��11.8 mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ�������ã�V��11.8mol/L=0.1mol/L��250mL�����V=2.1 mL������ʱ������Ҫ250mL����ƿ���⣬����Ҫ��Ͳ���ձ�������������ͷ�ιܣ�
��2������һ�����ʵ���Ũ�ȵ���Һ���裺���㡢�������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȵȣ�����ȷ��˳��Ϊ��BCAFED��
��3������A�У���ϴ��Һ����������ƿ����Ŀ���DZ�֤����ȫ��ת������ƿ����������ƿʢ������Һʱ���������Ҳ��������ƿը�ѣ������Һע������ƿǰ��ָ������£�
��4��������ˮʱ���������˿̶��ߣ���Һ������ӣ���Һ��Ũ��ƫС����Ҫϴ������ƿ���������ƣ�������ƿ��ת����Һʱ(ʵ�鲽���)������Һ�ε�������ƿ���棬���ʼ��٣���Һ��Ũ��ƫС����Ҫϴ������ƿ���������ơ�


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���л����ķ�����ᴿ�ṩ��ȷ�ķ���
�ٳ�ȥCa��OH��2��Һ��������CaCO3��
�ڷ������Ȼ�̼��ˮ�Ļ����
�۷������ͺ�ú��
���ᴿ�Ȼ��ƺ�����ػ�����е������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��

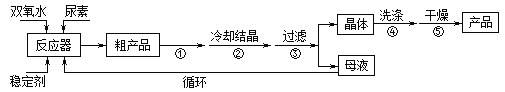
��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��ŵ������ѧ���ɷ�������������������λ��ѧ�ҷֻ��Ա����������������������о�����ijɾͣ�һ�ֹ�����������ṹ��ͼ��ʾ���йظ÷��ӵ�˵����ȷ����

A. �÷������ڷ�����
B. �����������Դ���ͬһƽ��
C. ����NaHCO3������KMnO4��Һ��Ӧ
D. 1mol�÷���������2molH2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2Y2-���Ҷ����������(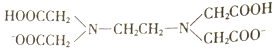 )�ļ�д��������ֽ��������γ�����
)�ļ�д��������ֽ��������γ�����
I. H2Y2-��Fe2+�γɵ������FeY2-���������������е�NO��������ԭ��:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) ��H<0
FeY2-(NO)(aq) ��H<0
��1������NO��������һ��������ͨ����ʼ�¶�Ϊ50����FeY2-��Һ�С�NO��������ͨ��������ʱ��仯����ͼ��ʱ��Խ����NO������Խ�͵�ԭ����_________��
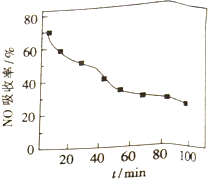
��2�����ɵ�FeY2-(NO)(aq)��ͨ���������ۻ�ԭ��������ԭ��:FeY2-(NO)(aq)+Fe+H2O��FeY2-(aq)+Fe(OH)2+NH3(δ��ƽ)��
������Һ��������14g���ۣ��������յ������к���NO�����ʵ���Ϊ_______��
II.���ͭ(CuY2-)��ˮ�Ĵ���һֱ�ǻ�������������о��ȵ㡣
��1��H2Y2-��Cu2+��Fe3+��Ca2+���������±�:
��Ϸ�Ӧ | lgK(KΪƽ�ⳣ��) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
��������ȶ��Ľ����������_____(�ѧʽ)���������ͭ(CuY2-)��ˮ�м���һ�ֻ�ɫ������ҺA�ɽ����Cu2+������A��������Ϊ________(�ѧʽ)��
������pH�ɽ��������Cu2+ת��ΪCu(OH)2��������Ҫʹc(Cu2+)��2.2��10-4mol/L��pHӦ������________(������Ksp[Cu(OH)2]= 2.2��10-20)��
��2���ǻ����ɻ�(-OH)��Na2FeO2�����������ͭ�е�Y4-��ʹCu2+�õ����롣
��������������-OH�ɽ�Y4-(C10H12O8N24-)��������CO2��H2O��N2���÷�Ӧ�����ӷ���ʽΪ___________________��
��Na2FeO4�����������²��ȶ�����Na2FeO4������ķ�ˮ��Cu2+��Ũ����pH�Ĺ�ϵ����ͼ��pHԽ����/span>��ˮ����Ч��Խ�ã�������Ϊ______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѱ����ں��պ��칤ҵ��������ҽ�Ƶ�������������(��Ҫ�ɷ�ΪFeTiO3)��ȡ�Ѳ���ø���Ʒ�̷��Ĺ�������������

��1��TiOSO4���ѵĻ��ϼ�Ϊ_________������I��������Ϊ_________��
��2��TiOSO4��ˮ���H2TiO3�Ļ�ѧ����ʽΪ_________��
��3��TIO2�뽹̿��Cl2�ڸ����·�Ӧ��TiCl4��������ԭ�����壬��Ӧ�Ļ�ѧ����ʽΪ_________��
��4������Mg��TiCl4�õ���ʱ��Ar��������_________��
��5��ij����3.8�ִ���Ϊ40%����������ȡ����������������Ҫ����______L(��״����)��
��6����֪K3[Fe(CN)6](���軯�ء���K4[Fe(CN)6]�������軯�����ܷ������·�Ӧ��3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2������ɫ��������4Fe3++3(Fe(CN)6]4-=Fe4[Fe(CN)6]3������ɫ������
��ȷ���̷����ֱ������ķ�����___________________________�����ɹ�ѡ����Լ������軯����Һ��������������Һ�����ۡ�KSCN��Һ��
�������£����̷����0.1mol��L-1FeSO4��Һ�������Һ��pH=3���������ӷ���ʽ����ԭ��_____________________������Һ��c(SO42-)-c(Fe2+)��_________________ mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ��ȿ�³����G������ͨ�����·����ϳɣ�

��1��B �еĺ�������������Ϊ__________________��
��2��B��C �ķ�Ӧ����Ϊ___________________��
��3��д��ͬʱ�������������� D ��һ��ͬ���칹��Ľṹ��ʽ��__________________��
���б���������ʹ��� CCl4 ��Һ��ɫ���۷������� 2 �ֲ�ͬ��ѧ��������
��4���ϳ� F ʱ����������һ�ָ����� X��X �Ľṹ��ʽΪ___________________��
��5����֪ �� ���� ��![]() �� �ױ����������Լױ��ͼ״�Ϊԭ���Ʊ�
�� �ױ����������Լױ��ͼ״�Ϊԭ���Ʊ� ��_____________________
��_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A. ����2HI(g)![]() H2(g)+I2(g)����ƽ�������С���������ʹ��ϵ��ɫ����
H2(g)+I2(g)����ƽ�������С���������ʹ��ϵ��ɫ����
B. ��ˮ��������ƽ��Br2+H2O![]() HBr+HBrO����������������Һ����Һ��ɫ��dz
HBr+HBrO����������������Һ����Һ��ɫ��dz
C. �ϳɰ���Ӧ��Ϊ��߰��IJ��ʣ�������Ӧ��ȡ�����¶ȵĴ�ʩ
D. ��ӦCO(g)+NO2(g)![]() CO2(g)+NO(g�� ��H��0����ƽ����������¶���ϵ��ɫ����
CO2(g)+NO(g�� ��H��0����ƽ����������¶���ϵ��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mLϡH2SO4��ϡHNO3�Ļ����Һ���������ۣ�����������۵������������������(��״��)֮��Ĺ�ϵ����ͼ��ʾ����ÿһ��ֻ��Ӧһ����Ӧ������˵����ȷ��

A. ��ʼʱ����������ΪH2
B. AB�β����ķ�ӦΪ�û���Ӧ
C. ���û����Һ��c(HNO3)��0.5mol��L��1
D. �μӷ�Ӧ���۵�������m2��5.6 g
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com