
苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使KMnO4(H+)溶液褪色;②苯分子中碳原子的距离均相等;③苯能在一定条件下跟H2加成生成环己烷;④经实验测得邻二甲苯仅一种结构;⑤苯在FeBr3存在条件下同液溴发生取代反应,但不因化学变化而使溴水褪色。
A.②③④⑤B.①③④⑤C.①②④⑤ D.①②③④
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式 ;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是 (填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | t |
(3)实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为 ;
T1 T2 (选填“>”、“<”或“=”),理由是 。尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-) 之比为 。
该溶液中c(OH—) = c(H+)+ + (用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 (用编号排序)
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | 浓盐酸 | HCl | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 |
|
|
| ① | ② |
| ③ |
|
三 |
| ④ | ⑤ | ⑥ |
|
| ⑦ | ⑧ |
四 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)在这些元素中,⑩原子的原子结构示意图为 。
(2)写出①的最高价氧化物和②的单质的电子式 , 。
(3)用电子式表示③与④形成化合物的过程 。
(4)①的单质和⑥的氧化物反应的化学方程式 。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于下图所示原电池装置的叙述中,正确的是

A.铜片是负极
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市红桥区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)以下是一些物质的熔沸点数据(常压):
| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:
4Na(g)+3CO2(g) 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】
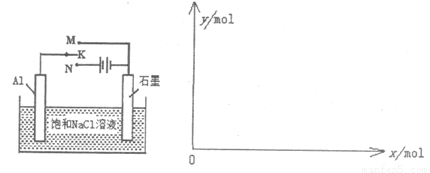
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:选择题
下列图示实验现象及其解释不正确的是( )
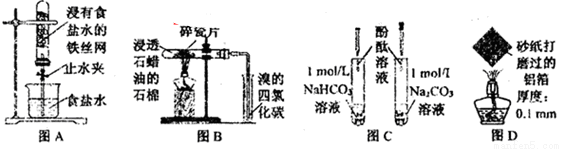
A.图A,一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀
B.图B,加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生
C.图C,溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32-
D.图D,加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
关于原子结构、元素性质的说法正确的是
A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.在化学反应中,原子首先失去的电子能量最低
D.在元素周期表中,各主族元素的最高化合价与其族序数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com