
”¾ĢāÄæ”æ(1)·“Ó¦Fe(s)£«CO2(g)![]() FeO(s)£«CO(g)””¦¤H1£¬Ę½ŗā³£ŹżĪŖK1£»·“Ó¦Fe(s)£«H2O(g)
FeO(s)£«CO(g)””¦¤H1£¬Ę½ŗā³£ŹżĪŖK1£»·“Ó¦Fe(s)£«H2O(g)![]() FeO(s)£«H2(g)””¦¤H2£¬Ę½ŗā³£ŹżĪŖK2£»ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ£ŗ
FeO(s)£«H2(g)””¦¤H2£¬Ę½ŗā³£ŹżĪŖK2£»ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ£ŗ
700 ”ę | 900 ”ę | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
¢Ł·“Ó¦CO2(g)£«H2(g)![]() CO(g)£«H2O(g)””¦¤HµÄĘ½ŗā³£ŹżĪŖK£¬Ōņ¦¤H£½________(ÓƦ¤H1ŗĶ¦¤H2±ķŹ¾)£¬K£½________(ÓĆK1ŗĶK2±ķŹ¾)£¬ĒŅÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬·“Ó¦CO2(g)£«H2(g)
CO(g)£«H2O(g)””¦¤HµÄĘ½ŗā³£ŹżĪŖK£¬Ōņ¦¤H£½________(ÓƦ¤H1ŗĶ¦¤H2±ķŹ¾)£¬K£½________(ÓĆK1ŗĶK2±ķŹ¾)£¬ĒŅÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬·“Ó¦CO2(g)£«H2(g)![]() CO(g)£«H2O(g)ŹĒ_____________________·“Ó¦(Ģī”°ĪüČČ”±»ņ”°·ÅČČ”±)”£
CO(g)£«H2O(g)ŹĒ_____________________·“Ó¦(Ģī”°ĪüČČ”±»ņ”°·ÅČČ”±)”£
¢ŚÄÜÅŠ¶ĻCO2(g)£«H2(g)![]() CO(g)£«H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ_______(Ģī×ÖÄø)”£
CO(g)£«H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ_______(Ģī×ÖÄø)”£
A£®ČŻĘ÷ÖŠŃ¹Ēæ²»±ä”””” B£®»ģŗĻĘųĢåÖŠc(CO)²»±ä
C£®vÕż(H2)£½vÄę(H2O) D£®c(CO)£½c(CO2)
(2)Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė×ćĮæĢś·Ū²¢³äČėŅ»¶ØĮæµÄCO2ĘųĢ壬·¢Éś·“Ó¦£ŗFe(s)£«CO2(g)![]() FeO(s)£«CO(g)””¦¤H>0£¬CO2µÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
FeO(s)£«CO(g)””¦¤H>0£¬CO2µÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
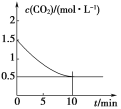
¢ŁøĆĢõ¼žĻĀ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ______£»ČōĢś·Ū×ćĮ棬CO2µÄĘšŹ¼ÅضČĪŖ2.0 mol”¤L£1£¬ŌņĘ½ŗāŹ±CO2µÄÅضČĪŖ______mol”¤L£1”£
¢ŚĻĀĮŠ“ėŹ©ÖŠÄÜŹ¹Ę½ŗāŹ± Ōö“óµÄŹĒ________(Ģī×ÖÄø)”£
Ōö“óµÄŹĒ________(Ģī×ÖÄø)”£
A£®ÉżøßĪĀ¶Č B£®Ōö“óŃ¹Ēæ
C£®³äČėŅ»¶ØĮæµÄCO2 D£®ŌŁ¼ÓČėŅ»¶ØĮæĢś·Ū
”¾“š°ø”榤H1£¦¤H2  ĪüČČ BC 2.0”” 0.67(»ņ2/3) A
ĪüČČ BC 2.0”” 0.67(»ņ2/3) A
”¾½āĪö”æ
£Ø1£©¢Łøł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł£¢ŚµĆ£ŗCO2(g)£«H2(g)![]() CO(g)£«H2O(g)””¦¤H£½¦¤H1£¦¤H2£»·“Ó¦Fe(s)£«CO2(g)
CO(g)£«H2O(g)””¦¤H£½¦¤H1£¦¤H2£»·“Ó¦Fe(s)£«CO2(g)![]() FeO(s)£«CO(g)µÄĘ½ŗā³£ŹżK1£½c(CO)/c(CO2)£¬·“Ó¦Fe(s)£«H2O(g)
FeO(s)£«CO(g)µÄĘ½ŗā³£ŹżK1£½c(CO)/c(CO2)£¬·“Ó¦Fe(s)£«H2O(g)![]() FeO(s)£«H2(g)µÄĘ½ŗā³£ŹżK2£½c(H2)/c(H2O)£¬Ōņ·“Ó¦CO2(g)£«H2(g)
FeO(s)£«H2(g)µÄĘ½ŗā³£ŹżK2£½c(H2)/c(H2O)£¬Ōņ·“Ó¦CO2(g)£«H2(g)![]() CO(g)£«H2O(g)µÄĘ½ŗā³£ŹżK£½c(CO)”¤c(H2O)/c(CO2)”¤c(H2)£½
CO(g)£«H2O(g)µÄĘ½ŗā³£ŹżK£½c(CO)”¤c(H2O)/c(CO2)”¤c(H2)£½![]() £»øł¾Ż±ķÖŠŹż¾ŻæÉÖŖĖęĪĀ¶ČµÄÉżøߣ¬K1Ōö“ó£¬K2¼õŠ”£¬ĖłŅŌKÖµĖęĪĀ¶ČÉżø߶ųŌö“ó£¬Ņņ“Ė·“Ó¦CO2(g)£«H2(g)
£»øł¾Ż±ķÖŠŹż¾ŻæÉÖŖĖęĪĀ¶ČµÄÉżøߣ¬K1Ōö“ó£¬K2¼õŠ”£¬ĖłŅŌKÖµĖęĪĀ¶ČÉżø߶ųŌö“ó£¬Ņņ“Ė·“Ó¦CO2(g)£«H2(g)![]() CO(g)£«H2O(g)ŹĒĪüČČ·“Ó¦”£¢ŚAĻī£¬øĆ·“Ó¦¹ż³ĢÖŠŃ¹ĒæĪŖŗćĮæ£¬Ń¹Ēæ²»±ä²»Ņ»¶ØĘ½ŗā£¬¹ŹA“ķĪó£»BĻī£¬»ģŗĻĘųĢåÖŠc(CO)²»±ä£¬Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬£¬¹ŹBÕżČ·£»CĻī£¬vÕż(H2)£½vÄę(H2O)= vÄę(H2)£¬ŌņĪŖĘ½ŗāדĢ¬£¬¹ŹCÕżČ·£»DĻī£¬c(CO)£½c(CO2)²»ÄÜĖµĆ÷vÕż£½vÄę£¬²»ÄÜĖµĆ÷ĘäÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬²»Ņ»¶ØĘ½ŗā£¬¹ŹD“ķĪó”£
CO(g)£«H2O(g)ŹĒĪüČČ·“Ó¦”£¢ŚAĻī£¬øĆ·“Ó¦¹ż³ĢÖŠŃ¹ĒæĪŖŗćĮæ£¬Ń¹Ēæ²»±ä²»Ņ»¶ØĘ½ŗā£¬¹ŹA“ķĪó£»BĻī£¬»ģŗĻĘųĢåÖŠc(CO)²»±ä£¬Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬£¬¹ŹBÕżČ·£»CĻī£¬vÕż(H2)£½vÄę(H2O)= vÄę(H2)£¬ŌņĪŖĘ½ŗāדĢ¬£¬¹ŹCÕżČ·£»DĻī£¬c(CO)£½c(CO2)²»ÄÜĖµĆ÷vÕż£½vÄę£¬²»ÄÜĖµĆ÷ĘäÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬²»Ņ»¶ØĘ½ŗā£¬¹ŹD“ķĪó”£
(2)ÓÉĶ¼ÖŠĒśĻßæÉµĆ£¬Ę½ŗāŹ±¶žŃõ»ÆĢ¼µÄÅضČĪŖ0.5 mol”¤L£1£¬ĻūŗĶžŃõ»ÆĢ¼µÄÅضČĪŖ1 mol”¤L£1£¬øł¾Ż»Æѧ·½³ĢŹ½£¬“ļµ½Ę½ŗāŹ±£¬c(CO)£½1 mol”¤L£1£¬øĆĢõ¼žĻĀ·“Ó¦µÄĘ½ŗā³£ŹżK£½c(CO)/c(CO2)£½(1 mol”¤L£1)/(0.5 mol”¤L£1)£½2.0£»ČōĢś·Ū×ćĮ棬CO2µÄĘšŹ¼ÅضČĪŖ2.0 mol”¤L£1£¬ĮŠČż¶ĪŹ½ČēĻĀ£ŗ
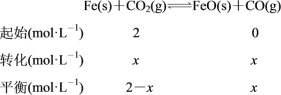
ŅņĪŖĪĀ¶ČĆ»±ä£¬ĖłŅŌK£½2£¬Ōņx”Ć(2£x)£½2£¬½āµĆx£½4/3£»ĖłŅŌĘ½ŗāŹ±CO2µÄÅضČĪŖ(2£4/3) mol”¤L£1£½2/3 mol”¤L£1”£
¢ŚAĻī£¬Õż·“Ó¦ĪüČČ£¬ÉżøßĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Ōņ![]() Ōö“󣬹ŹAÕżČ·£»BĻī£¬·“Ó¦Ē°ŗóĢå»ż²»±ä£¬Ōö“óŃ¹ĒæĘ½ŗā²»ŅĘ¶Æ£¬
Ōö“󣬹ŹAÕżČ·£»BĻī£¬·“Ó¦Ē°ŗóĢå»ż²»±ä£¬Ōö“óŃ¹ĒæĘ½ŗā²»ŅĘ¶Æ£¬![]() ²»±ä£»¹ŹB“ķĪó£»CĻī£¬ŌŁ³äČėŅ»¶ØĮæµÄCO2£¬ÓÉÓŚĘ½ŗā³£Źż²»±ä£¬Ōņ
²»±ä£»¹ŹB“ķĪó£»CĻī£¬ŌŁ³äČėŅ»¶ØĮæµÄCO2£¬ÓÉÓŚĘ½ŗā³£Źż²»±ä£¬Ōņ![]() ²»±ä£¬¹ŹC“ķĪó£»DĻī£¬ŌŁ¼ÓČėŅ»¶ØĮæĢś·Ū£¬Ę½ŗā²»ŅĘ¶Æ£¬
²»±ä£¬¹ŹC“ķĪó£»DĻī£¬ŌŁ¼ÓČėŅ»¶ØĮæĢś·Ū£¬Ę½ŗā²»ŅĘ¶Æ£¬![]() ²»±ä£¬¹ŹD“ķĪó”£×ŪÉĻĖłŹö£¬·ūŗĻĢāŅāµÄŃ”ĻīĪŖA”£
²»±ä£¬¹ŹD“ķĪó”£×ŪÉĻĖłŹö£¬·ūŗĻĢāŅāµÄŃ”ĻīĪŖA”£


 Ģ½¾æÓė¹®¹ĢŗÓÄĻæĘѧ¼¼Źõ³ö°ęÉēĻµĮŠ“š°ø
Ģ½¾æÓė¹®¹ĢŗÓÄĻæĘѧ¼¼Źõ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷¶ŌÓ¦µÄŹµŃéĻÖĻó¼°½āŹĶ»ņ½įĀŪ¶¼ÕżČ·µÄŹĒ(””””)
Ń”Ļī | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó | ½āŹĶ»ņ½įĀŪ |
A | ĻņFe(NO3)2ČÜŅŗÖŠµĪČėĮņĖįĖį»ÆµÄH2O2ČÜŅŗ | ČÜŅŗ±äĪŖ»ĘÉ« | Ńõ»ÆŠŌ£ŗH2O2>Fe3£« |
B | Ļņ5mL1mol/L NaOHČÜŅŗÖŠµĪ¼Ó5µĪ1mol/L MgCl2ČÜŅŗ£¬Č»ŗóŌŁµĪ¼Ó×ćĮæµÄ1mol/L CuCl2ČÜŅŗ | ĻČ²śÉś°×É«³Įµķ£¬Č»ŗó²śÉśĄ¶É«³Įµķ | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | ½«³äĀśNO2µÄĆܱղ£Į§Ēņ½žÅŻŌŚČČĖ®ÖŠ | ŗģ×ŲÉ«±äÉī | 2NO2(g) |
D | ĻņŅ»¶ØĮæĖįŠŌKMnO4ČÜŅŗÖŠ¼ÓČėŅŅ¶ž“¼£ØHOCH2CH2OH£© | ČÜŅŗ×ĻÉ«ĶŹČ„ | ŅŅ¶ž“¼±»Ńõ»ÆĪŖŅŅ¶žĖį |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×ĶéŗĶĖ®ÕōĘų·“Ó¦µÄ²śĪļŹĒŗĻ³É¼×“¼µÄŌĮĻ£ŗCH4+H2O![]() CO+3H2
CO+3H2
ŅŃÖŖ£ŗCO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4ĶźČ«·“Ó¦ŗóµÄ²śĪļÖŠ£¬¼ÓČė100 mol CO2ŗóŗĻ³É¼×“¼”£Čō»ńµĆ¼×“¼350 mol£¬²ŠĮōĒāĘų120 mol£¬¼ĘĖćCOŗĶCO2µÄ×Ŗ»ÆĀŹ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĪļÖŹµÄŠŌÖŹÓėÓĆĶ¾²»¶ŌÓ¦µÄŹĒ( )
A. ĀĮŗĻ½šµÄĆܶȊ”£¬Ó²¶Č“ó£¬æÉÓĆ×÷½ØÖž²ÄĮĻ
B. Ź³Ę·¹¤ŅµÖŠÓĆNa2CO3×÷±ŗÖĘøāµćµÄÅņĖɼĮ
C. FeCl3ČÜŅŗÄÜÓėCu·“Ó¦£¬æÉÓĆÓŚøÆŹ“ĶÖĘÓ”Ė¢µēĀ·°å
D. ¶žŃõ»Æ¹čŹĒÖĘŌģ¹āµ¼ĻĖĪ¬µÄ²ÄĮĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æH2S·ĻĘų׏Ō“»ÆµÄŌĄķĪŖ£ŗ2H2S(g)+O2(g)=S2(s)+2H2O(l) ¦¤H =£632 kJ”¤mol-1”£ĻĀĶ¼ĪŖH2SČ¼ĮĻµē³ŲµÄŹ¾ŅāĶ¼”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
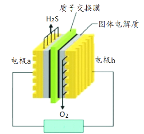
A. µē¼«bĪŖµē³ŲµÄøŗ¼«
B. µē¼«bÉĻ·¢ÉśµÄµē¼«·“Ó¦ĪŖ£ŗO2 + 2H2O + 4e£ = 4OH£
C. µēĀ·ÖŠĆæĮ÷¹ż4 molµē×Ó£¬µē³Ų»į²śÉś632 kJµēÄÜ
D. Ćæ34 g H2S²ĪÓė·“Ó¦£¬ÓŠ2 molH+¾ÖŹ×ÓĤ½ųČėÕż¼«Ēų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠ·“Ó¦£ŗmA (g) +nB (g)![]() pc (g) £¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßŲ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹżŅ²¼õŠ”£¬Ōņ£ŗ
pc (g) £¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßŲ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹżŅ²¼õŠ”£¬Ōņ£ŗ
£Ø1£©øĆ·“Ó¦µÄÄę·“Ó¦ĪŖ____ČČ·“Ó¦£¬ĒŅm+n____p (Ģī”°>”±”¢ ”°=”± ”¢”°<”±£©”£
£Ø2£©¼õŃ¹Ź±£¬AµÄÖŹĮæ·ÖŹż______.(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£¬ĻĀĶ¬£©
£Ø3£©Čō¼ÓČėB (Ģå»ż²»±ä£©£¬ŌņAµÄ×Ŗ»ÆĀŹ_____£¬BµÄ×Ŗ»ÆĀŹ_________”£
£Ø4£©ČōÉżøßŲ¶Č£¬ŌņĘ½ŗāŹ±B”¢CµÄÅضČÖ®±Č½«__________”£
£Ø5£©Čō¼ÓČė“߻ƼĮ£¬Ę½ŗāŹ±ĘųĢå»ģŗĻĪļµÄ×ÜĪļÖŹµÄĮæ______________”£
£Ø6£©ČōBŹĒÓŠÉ«ĪļÖŹ£¬A”¢C¾łĪŽÉ«£¬Ōņ¼ÓČėC (Ģå»ż²»±ä£©Ź±»ģŗĻĪļŃÕÉ«______£¬¶ųĪ¬³ÖČŻĘ÷ÄŚŃ¹Ēæ²»±ä£¬³äČėÄŹĘųŹ±£¬»ģŗĻĪļŃÕÉ«______(Ģī”°±äÉī”±”¢ ”°±äĒ³”±»ņ”°²»±ä”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ( )
A. æÉŅŌÓĆNaOHČÜŅŗ¼ų±šMgCl2ŗĶAlCl3 B. æÉŅŌÓĆäåĖ®¼ų±š¼×ĶéŗĶŅŅĻ©
C. æÉŅŌÓĆ·ÖŅŗĀ©¶··ÖĄėŅŅĖįŗĶŅŅ“¼ D. æÉŅŌÓĆNaOHČÜŅŗ³żČ„±½ÖŠÉŁĮæµÄBr2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢Éś3A(g)£«B(g) ![]() 2C(g)µÄ·“Ó¦£¬Čō×ī³õ¼ÓČėAŗĶB¶¼ŹĒ4mol£¬ AµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.12mol”¤L©1”¤s©1£¬Ōņ10sŗóČŻĘ÷ÖŠBµÄĪļÖŹµÄĮæŹĒ
2C(g)µÄ·“Ó¦£¬Čō×ī³õ¼ÓČėAŗĶB¶¼ŹĒ4mol£¬ AµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.12mol”¤L©1”¤s©1£¬Ōņ10sŗóČŻĘ÷ÖŠBµÄĪļÖŹµÄĮæŹĒ
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ³£ĪĀ³£Ń¹ĻĀ¶ĻĮŃ1 molÖø¶Ø¹²¼Ū¼üŹ±ĪüŹÕµÄÄÜĮæČēĻĀ±ķ£ŗ
¹²¼Ū¼ü(1mol) | C”ŖH¼ü | C”ŖC¼ü | C£½C¼ü | H”ŖH¼ü |
ĪüŹÕµÄÄÜĮæ/kJ | 413.4 | 347.7 | 615 | 436 |
ŌņĻĀĮŠÓŠ¹ŲCH2£½CH2£«H2”Ŗ”śCH3CH3·“Ó¦µÄĖµ·ØÕżČ·µÄŹĒ( )
A. Éś³É1molŅŅĶ鏱·“Ó¦·Å³öÄÜĮæ123.5kJ
B. Éś³ÉĪļµÄ×ÜÄÜĮæĪŖ2828.1kJ
C. øĆ·“Ó¦ĪŖ¼Ó³É·“Ó¦£¬æÉŅŌŹµĻÖĶźČ«×Ŗ»Æ
D. øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪŽŠč¼ÓČČ¼“æÉŹµĻÖ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com