
【题目】已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
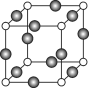
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。
【答案】(1)N>O>C;(2)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) ;
(3)C2H6,氮的氢化物(N2H4)分子间存在氢键;(4)sp2,4NA; ⑸Cu3N,6。
【解析】
试题分析:X是周期表中原子半径最小的元素,推出X为H,Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道的电子数相同,则Y为C,W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍,W的排布式为1s22s22p4,W为O,K位于ds区且原子的最外层电子数与H相同,即K为Cu,(1)同周期从左向右第一电离能增大,但IIA>IIIA、VA>VIA,即N>O>C;(2)Cu属于29号元素,位于第四周期IB族元素,即电子排布式为:1s22s22p63s23p63d104s1(或[Ar] 3d104s1) ;(3)C、H构成18电子分子,则化学式为C2H6,它们属于分子晶体,沸点相差较大,是因为含有氢键的缘故;(4)C、H、O组成的化合物为酸性,且分子量为46,此物质为HCOOH,其中C有3个σ键,无孤电子对,杂化轨道=价层电子对数,即杂化类型为sp2,成键原子之间只能形成1个σ键,即1mol甲酸中含有4molσ键,个数为4NA;(5)电子层数越多,半径越大,大球是Cu,小球为O,Cu为棱上,根据均摊法,原子个数为12×1/4=3,N的个数为8×1/8=1,化学式为Cu3N,N周围最近的Cu的个数有6个,即配位数为6。


科目:高中化学 来源: 题型:
【题目】雾霾中对人伤害最大的是PM2.5,即空气动力学直径小于2.5微米的粒子。分散质粒子直径约为2.5微米的分散系与下列哪种分散系最为接近
A.溶液 B.胶体 C.浊液 D.气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知土壤胶体微粒带负电荷,又有很大的接触面积,因而具有选择吸附能力。在土壤里施用含氮量相同的下列肥料,肥效最差的是
A.(NH4)2SO4 B.NH4HCO3 C.NH4NO3 D .NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 苯和甲苯互为同系物,都能使高锰酸钾褪色
B. 对二甲苯与氢气完全加成的产物的一氯代物有3种
C. 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
D. 淀粉、油脂、蛋白质的水解产物都是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是
A. “青蒿一握,以水二升渍,绞取汁”,上述对青蒿素的提取过程属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设Na为阿伏加德罗常数的值,下列叙述中一定正确的是 ( )
A.—定条件下,向0.1L容器内通入4.6 g NO2气体,NO2的物质的量浓度小于1mol/L
B.标准状况下,2.24 L HF中含有的极性键数目为0.1Na
C.50mL0.1mol/LCH3COOH溶液和 10mL0.5mol/LHCH3COOH溶液中所含CH3COOH分子数相等
D.1molFe与高温水蒸气反应,转移电子的数目为3Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com