
科目:高中化学 来源: 题型:
| A、在纯水中 |
| B、在0.1 mol?L-1的CH3COOH溶液中 |
| C、在0.1 mol?L-1的NH3?H2O溶液中 |
| D、在0.1 mol?L-1的MgCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1>△H2>△H3 |
| B、△H2>△H3>△H1 |
| C、△H1=△H2=△H3 |
| D、△H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得两个装置中均通过0.02mol电子时(不考虑盐的水解和溶液体积的变化)则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得两个装置中均通过0.02mol电子时(不考虑盐的水解和溶液体积的变化)则下列叙述中正确的是( )| A、电极上析出物质的质量:①=② |
| B、溶液的pH变化:①增大,②不变 |
| C、电极反应式:①中阳极 2Cl--2e-═Cl2↑ ②中负极 2H++2e-═H2↑ |
| D、产生气体的体积:①=② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
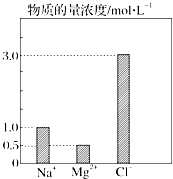 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g N2和28g CO所含的分子数都是NA |
| B、32g O3和32g O2所含的分子数都是NA |
| C、28g CO和44g CO2所含的氧原子数都是2NA |
| D、98g H2SO4和98g H3PO4所含的氧原子数都是4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com