
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
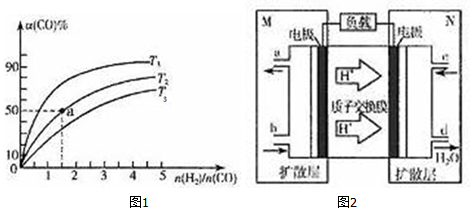
分析 (1)化学反应的焓变=反应物键能总和-生成物键能总和;
(2)①反应是放热反应,升高温度平衡逆向移动;
②a点时CO的转化率为50%,可计算各物质的浓度,以此解答平衡常数;化学平衡常数只与温度有关,要改变化学平衡常数只能改变温度;
(3)①原电池工作时,阳离子向正极移动,由氢离子的移动方向可知M为负极,N为正极,负极上甲醇失电子生成二氧化碳和氢离子;
②电流强度为0.5A,电池工作10min,则电量为0.5A×600s=300C,转移电子的物质的量为$\frac{300C}{96500C/mol}$,根据甲醇和转移电子之间的关系式计算甲醇质量.
解答 解:(1)CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1,△H=x+2a-(3d+b+c)=-99,x=b+c+3d-2a-99,
故答案为:b+c+3d-2a-99;
(2)①反应是放热反应,图象分析可是CO转化率随温度升高减小,则T3转化率最小,温度应最高,
故答案为:T3;
②a点时CO的转化率为50%,则CO(g)+2H2(g)?CH3OH
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡 (mol/L) 0.5 0.5 0.5
化学平衡常数K=$\frac{0.5}{0.5×0.{5}^{2}}$=4,
化学平衡常数只与温度有关,该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,要是平衡常数增大,应该降低温度,
故答案为:4;c;
(3)①原电池工作时,阳离子向正极移动,由氢离子的移动方向可知M为负极,N为正极,负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+,
故答案为:CH3OH+H2O-6e-=CO2+6H+;
②电流强度为0.5A,电池工作10min,则电量为0.5A×600s,转移电子的物质的量为$\frac{0.5A×600s}{96500C/mol}$,根据甲醇和转移电子之间的关系式得甲醇质量=$\frac{\frac{300C}{96500C/mol}}{6}×32g/mol$ $\frac{\frac{0.5A×600s}{96500C/mol}}{6}×32g/mol$=$\frac{0.5×600}{96500×6}×32$g,
故答案为:$\frac{0.5×600}{96500×6}×32$.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响、原电池原理等知识点,侧重考查学生分析计算及知识灵活应用能力,注意:化学平衡常数只与温度有关,与浓度、压强都无关,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的原子结构示意图: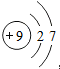 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com