硝化甘油(C3H5N3O9)分解时产物为N2、CO2、O2和液态水,它的分解反应的化学方程式是 .
已知20℃时,22.7g硝化甘油分解放出的热量为154KJ,则每生成1mol气体伴随放出的热量为 KJ.
【答案】
分析:利用观察法配平方程式;根据方程式可知,每摩尔硝化甘油分解产生的气体,由此计算出0.1mol硝化甘油分解产生气体,根据已知,可求出生成1mol气体放出的热量.
解答:解:配平方程式得:4C
3H
5N
3O
9
6N
2+12CO
2+O
2+10H
2O;硝化甘油的摩尔质量为227g/mol,
22.7g硝化甘油的物质的量为0.1mol,生成气体

×0.1mol,放出154KJ能量,
则生成1mol气体放出的热量为:154KJ÷

=324.2KJ,
故答案为:4C
3H
5N
3O
9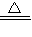
6N
2+12CO
2+O
2+10H
2O;324.2.
点评:本题计算时易把水当作气体来计算,注意20℃时水为液态.

 名校课堂系列答案
名校课堂系列答案