
【题目】工业上可利用电解原理,间接氧化降解处理含有机污染物的废水,其原理如图所示:
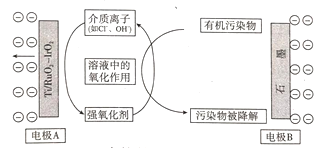
下列有关说法不正确的是( )
A.电极A是阳极,发生氧化反应
B.强氧化剂可能为Cl2、O2
C.有机污染物在石墨电极上被还原为无污染物
D.若介质离子为OH-,电极B上发生的反应为2H2O+2e- ═ H2↑+2OH-
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某工厂利用下列工艺以废旧铅蓄电池中含铅废料(主要含Pb、PbO、PbO2、PbSO4) 和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:

(1)含铅废料需要进行粉碎处理,其原因是____。
(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4。若生成1 mol PbSO4,则转移电子的物质的量为__mol。
(3)向滤液B中加入Na2CO3溶液能形成悬浊液,此时溶液中 =____。若再向此悬浊液中加入少量Pb(NO3)2固体,则
=____。若再向此悬浊液中加入少量Pb(NO3)2固体,则 将会 ___(填“增大”“减小”或“不变”)[Ksp(PbSO4)=1.8×10-8;Ksp(PbCO3)=3.6×10-14]
将会 ___(填“增大”“减小”或“不变”)[Ksp(PbSO4)=1.8×10-8;Ksp(PbCO3)=3.6×10-14]
(4)铅易造成环境污染。水溶液中铅的存在形态与水溶液pH的关系如图a所示。pH由7变化到6时,不同形态铅之间转化的离子方程式为_________________

(5)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,进一步电解Na2PbC14溶液生成Pb,如图b所示。
①阴极的电极反应式为 ___。
②电解一段时间后,Na2PbC14的浓度明显下降,为了增大其浓度且实现物质的循环利用,可在阴极区采取的方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:Ca2+、NH4+、Br、CH3COO
B.室温下 =1012的溶液中:Fe2+、Al3+、NO3-、SO42-
=1012的溶液中:Fe2+、Al3+、NO3-、SO42-
C.室温下水电离的c(H+)=10-12 mol·L-1的溶液:K+、HCO3-、Cl-、Ca2+
D.pH=13的溶液中:CO32-、Na+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO45H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
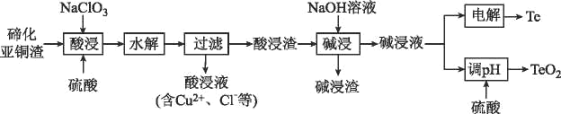
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:

选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜___________加入甲醛,且反应釜应装有________________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃由石英砂、___________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为______________。
(3)玻璃钢中玻璃纤维的作用是____________。玻璃钢具有__________等优异性能(写出两点即可)
(4)下列处理废旧热固性酚醛塑料的做法合理的是_____________
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一。
(1)氢氧燃料电池是一种高效无污染的清洁电池,用KOH溶液作电解质溶液,其负极反应式为_____________,理论上,正极消耗氧气2.8 L(标况下)时,电路中有__________mol e-通过。
(2)高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制双控开关,可交替得到H2和O2。
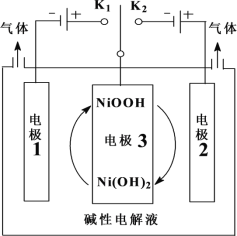
①太阳能光伏电池是将光能转化为__________能。
②当连接K1时可制得____________气体。
③当连接K2时,电极2附近pH_________(填“变大”、“变小”或“不变”)。
④当连接K2时,电极3作______极,其电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷石膏是硫酸分解磷矿制取磷酸过程中的副产物,其主要组分为CaSO4,氢气还原分解硫酸钙的部分反应如下:
①2CaSO4(s)=2CaO(s)+2SO2(g)+O2(g) ΔH1=akJ·mol-1
②CaSO4(s)+H2(g)=CaO(s)+H2O(l)+SO2(g) ΔH2=bkJ·mol-1
③CaSO4(s)+4H2(g)=CaS(s)+4H2O(l) ΔH3=ckJ·mol-1
④3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) ΔH4=dkJ·mol-1
下列说法正确的是( )
A.反应①中a<0
B.反应③在常温下能自发进行,说明c>0
C.c=4b-d
D.反应H2(g)+![]() O2(g)=H2O(l)的△H=(2b-a)kJmol-1
O2(g)=H2O(l)的△H=(2b-a)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。下列叙述正确的是
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。下列叙述正确的是
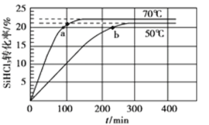
A.正反应方向为放热反应
B.反应速率大小:va <vb
C.70 ℃时,平衡常数K =![]()
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
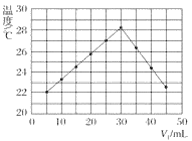
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com