

| A. | 装置①是电解Na2SO4溶液联合生产硫酸和烧碱示意图,若气体甲,乙的体积比约为1:2,则离子交换膜c、d均为阴离子交换膜,产物丙为硫酸溶液 | |
| B. | 装置②是以肼(N2H4)为燃料的电池装置,a极的反应式:N2H4+4OH--4e-=N2↑+4H2O | |
| C. | 装置③是在待镀铁制品上镀铜的实验装置,电镀过程中电极Ⅱ上Cu2+放电而使溶液中Cu2+浓度逐渐变小 | |
| D. | 装置④是金属牺牲阳极的阴极保护法实验装置,加入K3[Fe(CN)6]溶液后,Fe电极附近会产生蓝色沉淀 |
分析 A.装置①电解硫酸钠溶液时,阳极上OH-放电生成O2、阴极上H+放电生成H2,所以实质上是电解H2O,同温同压下,转移电子相等时生成H2、O2的体积之比为2:1,同温同压下,气体甲与气体乙的体积比约为1:2,则甲是O2、乙是H2,所以a是阳极、b是阴极;阳极附近有H+生成,阴极附近有OH-生成,c为阴离子交换膜,d为阳离子交换膜,硫酸根通过阴离子交换膜进入左室,所以产物丙是H2SO4,钠离子通过阳离子交换膜进入右室,所以产物丁是NaOH;
B.装置②是燃料电池,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O;
C.装置③是在铁上镀铜,铁作阴极,铜作阳极,阴极上铜离子得电子生成铜单质,阳极上铜失电子生成铜离子进入溶液,阴阳极上得失电子相等,阳极消耗的铜等于阴极上析出的铜;
D.装置④中锌的金属性强于铁,与铁构成原电池,在酸性条件下发生析氢腐蚀,锌易失电子作负极,铁作正极,铁被保护.
解答 解:A.装置①是电解Na2SO4溶液联合生产硫酸和烧碱示意图,若气体甲、乙的体积比约为1:2,气体甲为氧气,气体乙为氢气,c为阴离子交换膜,d为阳离子交换膜,产物丙为硫酸溶液,故A错误;
B.装置②是以肼(N2H4)为燃料的电池装置,a极的反应式:N2H4+4OH--4e-=N2↑+4H2O,故B正确;
C.装置③是在待镀铁制品上镀铜的实验装置,电镀过程中电极Ⅱ上Cu2+得电子变成Cu,电极I上Cu失电子变成Cu2+进入溶液中,溶液中Cu2+浓度不变,故C错误;
D.装置④是金属牺牲阳极的阴极保护法实验装置,Zn失电子被消耗,Fe得电子被保护,加入K3[Fe(CN)6]溶液后,由于Fe电极被保护,Fe电极附近不会产生特征蓝色的沉淀,故D错误;
故选B.
点评 本题综合考查了原电池和电解池的工作原理,为高频考点,侧重学生分析能力、应用能力的考查,明确原电池正负极的判断方法、电解池中离子放电顺序、离子交换膜的作用即可解答,题目难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 1mol Na2O2 固体中含阴阳离子的数目为3NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
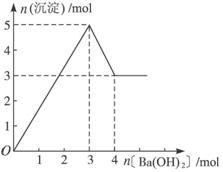 如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )
如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO 4 | B. | Al 2(SO 4) 3 | C. | Fe 2(SO 4) 3 | D. | NaAlO 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基含10 NA个电子 | |
| B. | 标准状况下,11.2L四氯化碳所含分子总数为0.5NA | |
| C. | 1 mol聚乙烯含有的原子总数目为6NA | |
| D. | 20℃时,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应进行30s时,正反应速率等于逆反应速率 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 前60 s,以X浓度变化表示的平均反应速率为0.0005mol/(L•s) | |
| D. | 反应进行80s时,X物质的量浓度为0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系:
A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com