
| A. | H2O2对Cu和稀硫酸的反应起催化作用 | |
| B. | 反应过程中的还原产物是SO2 | |
| C. | 若Cu和硫酸恰好完全反应,则原稀硫酸的物质的量浓度为0.75mol•L-1 | |
| D. | 反应过程中,还原剂和氧化剂的物质的量之比为1:2 |
分析 发生Cu+H2O2+2H+=Cu2++2H2O,Cu元素的化合价升高,O元素的化合价降低,以此来解答.
解答 解:A.酸性条件下H2O2可氧化Cu,故A错误;
B.该反应中无SO2生成,故B错误;
C.n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,由Cu+H2O2+2H+=Cu2++2H2O可知,硫酸为0.15mol,其浓度为$\frac{0.15mol}{0.2L}$=0.75mol/L,故C正确;
D.Cu为还原剂,过氧化氢为氧化剂,由反应可知还原剂和氧化剂的物质的量之比为1:1,故D错误;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意硫酸为二元酸,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “卤水点豆腐” | |
| B. | 明矾可用作净水剂 | |
| C. | 在电影院看电影,会看到从放映室到银幕的光柱 | |
| D. | 向氯化铁溶液中加入过量氢氧化钠溶液会看到红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| B. | 氢氧化铝具有弱碱性,是医用中常见的胃酸中和剂 | |
| C. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| D. | 液氨气化时要吸收大量的热,使周围温度降低,因而液氨可作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 气体发生装置 | 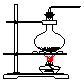 a | 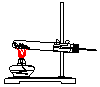 b |  c |
| 气体收集装置 |  2 |  ② |  ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、NO3-、Fe2+、Na+ | B. | K+、Ba2+、OH-、SO42- | ||
| C. | Ag+、NO3-、Cl-、K+ | D. | Cu2+、NH4+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com