
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
【答案】C
【解析】试题分析:A.该反应中N元素化合价由+3价变为+5价,所以亚硝酸根离子失电子被氧化,为还原剂,故A错误;B.根据元素守恒、电荷守恒知,K是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B错误;C.根据转移电子守恒得,生成1molNaNO3需消耗KMnO4的物质的量=![]() =0.4mol,故C正确;D.根据元素守恒、电荷守恒知,□中的粒子是H+,故D错误;故选A。
=0.4mol,故C正确;D.根据元素守恒、电荷守恒知,□中的粒子是H+,故D错误;故选A。
【名师点晴】为高频考点,注意根据反应中元素的化合价变化为解答的关键,该反应中锰元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,结合元素守恒、硝酸钠和高锰酸钾之间的关系式分析解答。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
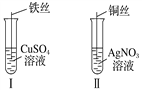
①Ⅰ中铁丝上观察到的现象是______________________;
②Ⅱ中发生反应的离子方程式为_______________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_____________。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热。
①写出制备氢氧化铁胶体的化学方程式____________________.
②向氢氧化铁胶体中逐滴滴入过量盐酸,出现的实验现象为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【哈师大附中2017届第四次模拟考试】常温下,在pH=1的某溶液中可能有Na+、Fe3+、Fe2+、I-、Cl- 、CO32-中的几种,现取100mL该溶液进行如下实验。根据实验结果,下列判断正确的是

A.Fe2+、I-、Cl-三种离子一定存在
B.CO32-一定不存在,不能确定Na+和Cl-是否存在
C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl-)至少为0.2molL1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
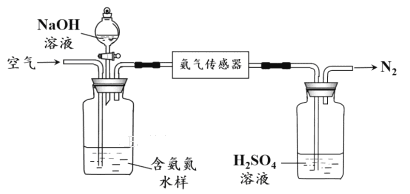
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。

① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质气化或熔化时,所克服的微粒间作用力完全相同的是 ( )
A.碘的升华和干冰气化B.二氧化硅熔化和干冰气化
C.苯气化和硝酸钾熔化D.食盐熔化和冰融化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。试回答:
(1)软锰矿制备K2MnO4的化学方程式是____________________________。
(2)K2MnO4制备KMnO4的离子方程式是__________________________________。
(3)KMnO4能与热的稀硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是________________________________________________。
(II)检验Na2SO3样品部分被氧化的实验操作及现象_____________________。
(III)在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌—空气电池是金属空气电池的一种,电解质溶液为KOH溶液时,反应为:2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列有关说法正确的是
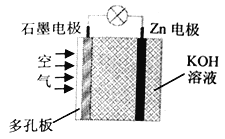
A. 石墨电极上发生氧化反应 B. 正极附近溶液的pH不断减小
C. OH-由锌电极移向石墨电极 D. Zn 电极上发生反应:Zn-2e-+4OH-=Zn(OH)42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,能大量共存的离子组是
A. Na+、K+、OH-、Cl- B. K+、Fe2+、Cl-、NO3-
C. Na+、ClO-、.SO42-、I- D. Mg2+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
![]() (浓)
(浓)![]()
![]()
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于________(用字母代号填写)
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
A物质可以使酸性![]() 溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
(2)一定量的铜片与100mL 18 mol/L的浓![]() 充分反应,如果该反应过程中转移了0.2mol电子,生成的
充分反应,如果该反应过程中转移了0.2mol电子,生成的![]() 的质量为_____g。
的质量为_____g。
(3)将反应后所得到的溶液与足量![]() 溶液充分反应。请写出此过程发生的反应的离子方程式:______________________。
溶液充分反应。请写出此过程发生的反应的离子方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com