
����Ŀ���ס��ҡ������ֲ�ͬ�������о�����ͬһ��Ԫ�أ�����֮���ת����ϵ��ͼʾ(���ַ�Ӧ�P����������ȥ)������˵��������ǣ�
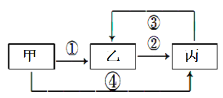
A.����Ϊ��̬�⻯���Ϊ����ɫ���壬�������Ư����
B.����Ϊ���嵥�ʣ���Ϊ���м��Թ��ۼ��ķǼ��Է��ӣ���Ӧ��Ϊ���ȷ�Ӧ
C.����Ϊ����������ҵ�ˮ��Һ�����ԣ����������ǿ��������ǿ�Ӧ
D.����Ϊ�������ʣ���Ӧ��Ϊ�û���Ӧ����������Һ�еμ�KSCN����Һ��ΪѪ��ɫ
���𰸡�C
��������
A. ����Ϊ��̬�⻯��(H2S)����Ϊ����ɫ����(S)���������Ư����(SO2)�������ʶ�������ͷ��ָ������ת����A��ȷ��
B. ����Ϊ���嵥��(O2)����Ϊ���м��Թ��ۼ��ķǼ��Է���(CO2)����Ӧ��(C+CO2)Ϊ���ȷ�Ӧ�������ʶ�������ͷ��ָ������ת����B��ȷ��
C. ����Ϊ����������(Al2O3)���ҵ�ˮ��Һ������(AlCl3)�����[Al(OH)3]������ǿ��������ǿ�Ӧ����Щ���ʶ���ת�������ײ���ת��Ϊ��������C����
D. ����Ϊ��������(Fe)����Ӧ��(Fe+CuCl2)Ϊ�û���Ӧ��������(FeCl3)��Һ�еμ�KSCN����Һ��ΪѪ��ɫ����ͷ��ָ�ĸ����ʼ䶼�ܷ���ת����D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(1)Fe2(SO4)3(д�����뷽��ʽ)_____
(2)��������������Һ���(д����Ӧ�����ӷ���ʽ)_____
(3)2H++CO32���TH2O+CO2��(��д�ɻ�ѧ����ʽ)________
(4)��ȥNaHCO3��Һ�л������� Na2CO3��Һ�����ӷ�Ӧ����ʽ_____��
����һƿ��Һֻ��Cl����CO32����SO42����Na+��Mg2+��Cu2+���������е�ij����ͨ��ʵ�飺
��ԭ��Һ![]() ��ɫ������
��ɫ������
��ԭ��Һ�м�BaCl2��Һ������������
��ԭ��Һ�м�AgNO3��Һ������ɫ�������ټ�ϡ�����ɫ�������ܽ⣮
(1)�Է���ԭ��Һ��һ�����е�������_____��һ�������е�������_____��
(2)�е�ͬѧ��Ϊʵ��ۿ���ʡ�ԣ�����Ϊ�Ƿ���ȷ_____(���ǻ��)��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���2. 0�����N2��6. 0�����H2ͨ��һ��������������ɱ�������У�������һ���������ͨ�������з������·�Ӧ��N2��3H2![]() 2NH3����֪ƽ��ʱNH3��Ũ����c mol��L��1���ְ��������������Ϊ��ʼ���ʣ��ֱ���������������������¶Ȳ��䣬��ﵽƽ���NH3��Ũ����Ϊc mol��L��1����( )
2NH3����֪ƽ��ʱNH3��Ũ����c mol��L��1���ְ��������������Ϊ��ʼ���ʣ��ֱ���������������������¶Ȳ��䣬��ﵽƽ���NH3��Ũ����Ϊc mol��L��1����( )
A. 1.0�����N2��3.0�����H2
B. 2.0�����N2��6.0�����H2��4.0�����NH3
C. 4.0�����NH3��1.0�����H2
D. 2.0�����NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ij�о���ѧϰС�飬Ϊ��̽���缫��ԭ��صĵ����֮���ϵ�����������ʵ�鷽��������Ƭ��ͭƬ��þƬ���缫���ֱ���������Һ����ԭ��أ����ӵ�������
��1�����������ҺΪ0.5mol/L���ᣬ�缫ΪͭƬ����Ƭ����Ƭ�ϵĵ缫�ķ�ӦʽΪ_________��
��2������Ũ�������������Һ���缫ΪͭƬ����Ƭ����ƬΪ____�����������������������������Ϸ����ĵ缫��ӦʽΪ_________��
��3�����������ҺΪ0.5mol/L����������Һ���缫ΪþƬ����Ƭ�������������ĵ缫��ӦΪ______��
����������(N2H4)�ֳ��������ڳ�������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ�����H2O���ų�����624kJ(25��ʱ)��N2H4��ȫȼ�յ��Ȼ�ѧ����ʽ��_______________________________________����һ����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20����30����KOH��Һ����һ����ȼ�ϵ�طŵ�ʱ�������ĵ缫��Ӧʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Ȼ�ѧ����ʽC(s) + H2O(g) ![]() CO(g) + H2(g)����H = +131.3 kJ/mol��ʾ________
CO(g) + H2(g)����H = +131.3 kJ/mol��ʾ________
A��̼��ˮ��Ӧ����131.3kJ����
B��1mol̼��1molˮ��Ӧ����һ����̼������������131.3kJ����
C�� 1mol��̬̼��1molˮ������Ӧ����1molһ����̼�����1mol������������131.3kJ ����
D��1����̬̼ԭ�Ӻ�1����ˮ������Ӧ����131.1kJ
��2���������ӷ���ʽ�У�����ˮ�ⷴӦ����_______________
A��CH3COOH+H2O![]() CH3COO�� + H3O+ B��CO2+H2O
CH3COO�� + H3O+ B��CO2+H2O![]() HCO3�� + H+
HCO3�� + H+
C��CO32�� + H2O![]() HCO3�� + OH�� D��HS�� + H2O
HCO3�� + OH�� D��HS�� + H2O![]() S2�� + H3O+
S2�� + H3O+
��3����A��B��C��D�Ŀ����Ƭ����������ʵ�飬
��A��B�õ���������ͬʱ����ϡH2SO4�У�A��Ϊ����
��C��D�õ���������ͬʱ����ϡH2SO4�У�������C��������D
��A��C������ͬʱ����ϡH2SO4��C��������������
��B��D������ͬʱ����ϡH2SO4�У�D������������Ӧ�������ֽ����Ļ��˳��Ϊ___________
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
��4����һ�������£����з�Ӧ��2SO2 (g)+O2 (g)=2SO3 (g) ��H<0�ﵽƽ��״̬
���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��__________________________
��������������ʱ�����¶ȣ����������ת����______________��������������䡱�������١�����ѧ��Ӧ����_________________������������䡱�������١���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҿ�����KMnO4�����Ũ���ᷴӦ�Ʊ���������ѧ����ʽ���£�2KMnO4 �� 16HCl��Ũ�� �� 2KCl �� 2MnCl 2�� 5Cl 2�� �� 8H2O��
��1���õ����ű������ת�Ƶķ������Ŀ:__________��
��2�����˷�Ӧ��дΪ���ӷ���ʽ��___________________��
��3����31.6g KMnO4�����Ũ�����ַ�Ӧ����������HCl�����ʵ���Ϊ_____���ڱ�״�������ɵ�Cl 2�����Ϊ____��
��4�������ɵ�����ͨ�������װ������֤������ijЩ���ʡ�
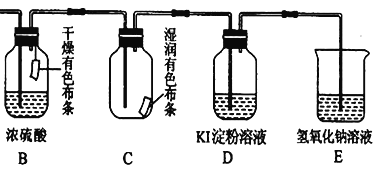
�����ӷ���ʽ����C����ɫ������ɫ��ԭ��______________����B��C��˳��ߵ����ɷ�ﵽԭ����ʵ��Ŀ�ģ�______����������������������������D�����������������ʵ�ʵ�飬�ɹ۲쵽��Һ����ɫ��Ϊ��ɫ��I2���������۱���ɫ������Ƚ�Cl2��I2 ��KMnO4 �������ԣ���ǿ����Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000mol��L-1NaOH��Һ�ζ�20.00mL0.1000mol��L-1HA��Һ���õζ�������ͼ������˵������ȷ����

A.HA�ĵ���ƽ�ⳣ��Ka=10-5
B.�����ʾ����Һ�У�2c(Na+)=c(A-)+c(HA)
C.�����ʾ����Һ�У�c(HA)>c(OH-)-c(H+)
D.�����ʾ����Һ�У�2c(OH-)-2c(H+)=c(A-)+3c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У�����ȷ���ǣ� ��
A.0.1 mol N2��������2.8 g
B.���³�ѹ�£�22 g CO2��������ԭ����ԼΪ6.02��1023
C.2 L 0.1mol��L��1NaCl��Һ�У�c(Na��)��0.2mol��L��1
D.��״���£�11.2 L O2���е�ԭ����ĿԼΪ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ӿ������幹��ʾ��ͼ����ͼ��ʾ��


(1)��M���������ӣ���N���������ӣ�д�������Ӿ������ɱ���ʽ��
A��__________��B��________��C��________��D��__________________________��
(2)��֪FeS2����(���������Ҫ�ɷ�)����A������ṹ��
��FeS2�����о��еĻ�ѧ��������__________________________________________��
��������ṹA�����ڵ����������Ӽ�ľ���Ϊacm������NA���������ӵ���������FeS2������ܶ���________g��cm��3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com