
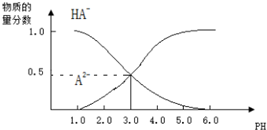
| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | pH=4.0时,图中n(HA-)约为0.0091mol |
分析 A.由图可知0.1mol/L H2A溶液中全部电离为HA-,说明第一步电离为完全电离;
B.H2A溶液中全部电离,不存在H2A分子;
C.混合溶液的pH与NaHA、Na2A的浓度有关;
D.根据Ka=$\frac{c({A}^{2-})×c({H}^{+})}{c(H{A}^{-})}$计算出$\frac{c({A}^{2-})}{c(H{A}^{-})}$,由$\frac{c({A}^{2-})}{c(H{A}^{-})}$=$\frac{n({A}^{2-})}{n(H{A}^{-})}$,结合原溶液中n(HA-)+n(A2-)=0.1mol计算.
解答 解:A.由图可知0.1mol/L H2A溶液中全部电离为HA-,说明第一步电离为完全电离,所以H2A的电离方程式为:H2A=H++HA-,HA-?H++A2-,故A错误;
B.H2A溶液中全部电离,不存在H2A分子,则由物料守恒可知,c(A2-)+c(HA-)=0.1mol/L,故B错误;
C.混合溶液的pH与NaHA、Na2A的浓度有关,若二者的浓度很小,则溶液的pH不可能等于3,故C错误;
D.当pH=3时,c(A2-)=c(HA-),则Ka=$\frac{c({A}^{2-})×c({H}^{+})}{c(H{A}^{-})}$=10-3,当pH=4时,Ka=$\frac{c({A}^{2-})×c({H}^{+})}{c(H{A}^{-})}$=10-3,则$\frac{c({A}^{2-})}{c(H{A}^{-})}$=$\frac{10}{1}$,所以$\frac{n({A}^{2-})}{n(H{A}^{-})}$=$\frac{10}{1}$,已知1L0.1mol/L H2A溶液中,n(HA-)+n(A2-)=0.1mol,所以n(HA-)=0.1mol×$\frac{1}{11}$≈0.0091mol,故D正确.
故选D.
点评 本题考查了弱电解质的电离、电离常数的有关计算,题目难度中等,注意把握弱电解质电离常数的有关计算方法,侧重于考查学生的分析能力、计算能力以及对图象中信息的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学卷(解析版) 题型:选择题
已知某可逆反应:mA(g)+nB(g)  pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
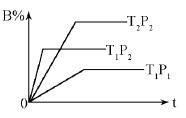
A.T1<T2 P1>P2 m+n>p ΔΗ<0
B.T1>T2 P1<P2 m+n<p ΔΗ>0
C.T1<T2 P1>P2 m+n<p ΔΗ<0
D.T1 >T2 P1<P2 m+n>p ΔΗ>0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学b卷(解析版) 题型:选择题
下列仪器常用于物质分离的是
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
A.①③⑤ B.①②⑥ C.①③④ D.①③⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
不用其他试剂,用最简单的方法鉴别下列物质
①NaOH溶液 ②Mg(NO3)2溶液 ③CuSO4溶液 ④KCl溶液,正确的鉴别顺序是
A.①②③④ B.③④②① C.④①③② D.③①②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
下列实验操作中错误的是
A.进行蒸发操作时,蒸发皿中出现大量固体时,即可停止加热
B.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喝咖啡加糖 | B. | 炒菜加味精 | ||
| C. | 加工食品时添加防腐剂 | D. | 炒菜时加碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
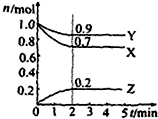 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质的分子内不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | NaCl晶体熔化,需要破坏离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com