
| A. | 天然油脂的主要成分是高级脂肪酸 | |
| B. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应 |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LC2H5OH含有的氢原子数为3NA | |
| B. | 高温下,16.8gFe与足量水蒸气完全反应失去的电子数为0.8 NA | |
| C. | 0.1mol/L CH3COONa溶液中CH3COO-和CH3COOH的总数为0.1 NA | |
| D. | 密闭容器中,46gNO2和N2O4的混合气体所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定不含Fe3+ | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定不含Cu2+ | D. | 剩余固体中一定含Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K11=4.3×10-7 |
| K12=5.6×10-11 |
| A. | c(HCO3-)>c(ClO-)>c(OH-) | B. | c(ClO-)>c(HCO3-)>c(H+) | ||
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)=c(ClO-)+c(OH-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
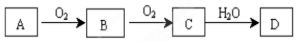
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间的变化而变化 | B. | X的消耗速率与Z的消耗速率相等 | ||
| C. | X、Y、Z、W的浓度相等 | D. | 总质量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应正反应是放热反应 | |
| B. | 该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0 | |
| C. | 在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100 | |
| D. | 工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用于制造光导纤维 | |
| B. | 盛氢氧化钠溶液的试剂瓶不能用玻璃塞 | |
| C. | 氯气可用于制取漂白粉 | |
| D. | 氢氧化铝可用于制造中和胃酸的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
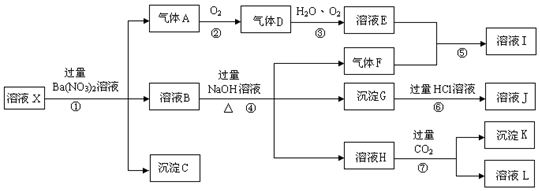
 ,实验中,可以观察到反应②的现象是:无色气体变为红棕色.
,实验中,可以观察到反应②的现象是:无色气体变为红棕色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com