
分析 用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,据此选择需要的仪器;
依据离子方程式:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O 计算亚硫酸的物质的量,进而计算样品的质量分数.
解答 解:用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、胶头滴管,所以还缺少的仪器:胶头滴管;
用高锰酸钾滴定亚硫酸钠,依据方程式得:
5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O
5 2
n 0.050mol/L×0.02L
则:5:2=n:0.050mol/L×0.02L
解得n=0.0025mol,
则4.0g样品中含有亚硫酸的质量为0.0025mol×10×126g/mol=3.15g,所以样品中亚硫酸钠的质量分数为:$\frac{3.15g}{4.0g}$×100%=78.8%;
故答案为:胶头滴管;78.8%.
点评 本题考查了质量百分数计算,涉及一定物质的量浓度溶液的配制,氧化还原滴定,明确配制一定物质的量浓度溶液的一般步骤,熟悉氧化还原反应滴定的原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
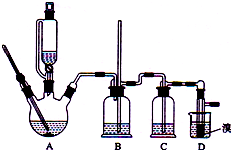 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2 )/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
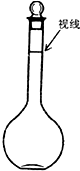 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com