
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
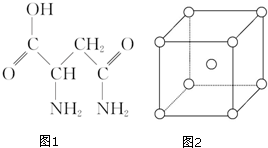 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
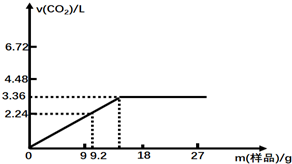
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
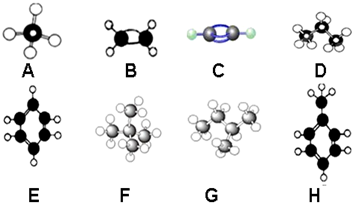
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
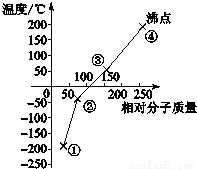
| A. | 单质①是最活泼的非金属单质 | |
| B. | 单质②能使品红溶液褪色 | |
| C. | 保存少量的单质③时加少量水进行水封 | |
| D. | 单质④的氢化物在卤素氢化物中沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
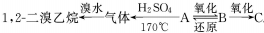 ,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;
,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
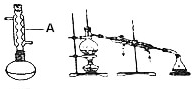 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下: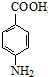 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$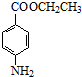 +H2O.
+H2O.| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 339.9 | 微溶于水 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定 | |
| C. | 往锥形瓶中加待测液时,锥形瓶中有少许水 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com