
| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.25g/mL×36.5% |
| 36.5g/mol |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、绿色化学就是研究绿色物质的化学 |
| B、烷烃是一类饱和链烃,其分子都是直线型的 |
| C、甲烷是烷烃中碳元素的质量分数最低的,也是最简单的烃 |
| D、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
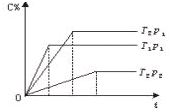 可逆反应:2A(g)+B(g)?2C(g)在温度分别为T1、T2,压强分别为p1、p2条件下测得C的体积分数与时间t的关系如图所示,下列判断正确的是:
可逆反应:2A(g)+B(g)?2C(g)在温度分别为T1、T2,压强分别为p1、p2条件下测得C的体积分数与时间t的关系如图所示,下列判断正确的是:| A、p2<p1,逆反应放热 |
| B、p2>p1,正反应放热 |
| C、p2>p1,正反应吸热 |
| D、p2<p1,逆反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、C、D的物质的量浓度相等 |
| B、混合气体的密度不再改变 |
| C、气体的总物质的量不再改变 |
| D、v(B)=2v(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | XOH物质的量浓度(mol?L-1) | HCl物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
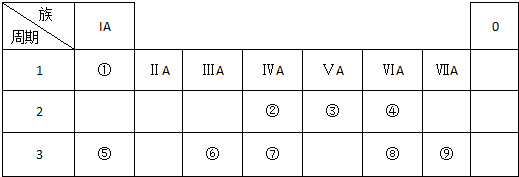
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com