
以氯化钾和硫酸亚铁原料生产硫酸钾和氧化铁红颜料,其主要流程如下:
已知: 溶液呈碱性,30℃以上溶液中
溶液呈碱性,30℃以上溶液中 大量分解。
大量分解。
(1)写出 溶液中的物料守恒___________________________________
溶液中的物料守恒___________________________________
(2)写出沉淀池I中反应的化学方程式_______________________,该反应必须控制的反应条件是___________________________。
(3)检验沉淀I中 沉淀是否完全的方法是__________________________________。
沉淀是否完全的方法是__________________________________。
(4)酸化的目的是___________________________。
(5)在沉淀池II中,为使 晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
(6)N、P、K、S都是植物生长所需的重要元素。滤液A可做复合肥料,因为其中含有___________等元素。
(7)中国海洋大学应用化学研究所在乙醇燃料电池技术方面获得突破,组装出了自呼吸电池及主动式电堆。乙醇燃料电池的工作原理如图怕示。
①该电池工作时,c口通入的物质为___________。
②该电池负极的电极反应式为_____________________________________。
(1)[NH4+]+[NH3?H2O]=[CO32?]+[H2CO3]+[HCO3?] (2分)
(2)2NH4HCO3 + FeSO4 = FeCO3↓+ (NH4)2SO4 + CO2↑+ H2O (2分);反应温度低于30℃ (1分)
(3)取沉淀池Ⅰ的滤液,滴加KSCN溶液后滴加氯水,若无红色出现,说明沉淀完全。(合理即可)(2分)
(4)除去溶液中的HCO3? (2分)
(5)普通漏斗、烧杯、玻璃棒(2分 不全得1分,下同)
(6)K、S 、K (2分)
(7)O2(1分);C2H6O – 12e? + 3H2O = 2CO2 +12H+(2分)
解析试题分析:(1)物料守恒的实质是元素守恒,NH4HCO3溶液中N元素与C元素物质的量相等,所以[NH4+]+[NH3?H2O]=[CO32?]+[H2CO3]+[HCO3?]
(2)碳酸氢根离子和亚铁离子之间发生双水解反应生成碳酸亚铁沉淀,并放出二氧化碳,反应的原理方程式为:2NH4HCO3+FeSO4=FeCO3↓+(NH4 )2SO4+CO2↑+H2O,为防止较高温度下碳酸氢铵的分解,要注意温度的选择,反应温度低于30℃。
(3)亚铁离子可以被氯气氧化为三价铁离子,亚铁离子遇到硫氰酸钾不显色,但是三价铁遇到硫氰酸钾显示红色,检验沉淀池I中Fe2+沉淀是否完全的方法是:取沉淀池I的滤液,滴加KSCN溶液后滴加氯水,若无红色出现,说明沉淀完全。
(4)沉淀池Ⅰ中,除了生成的碳酸亚铁之外,溶液汇总会含有过量的碳酸氢铵,加入酸,酸化的目的是除去溶液中的HCO3-。
(5)由题目看出在Ⅲ反应中生成的K2SO4为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
(6)滤液A的成分中含有(NH4 )2SO4以及KCl,即含有N、S、K元素,属于复合肥料。
(7)根据图中H+移动方向,可知右侧电极为燃料电池的正极,所以c口通入的物质为O2;由图可知电解质溶液中含H+,所以乙醇和水反应,根据化合价的变化,C2H5OH失去12e?,可得电极方程式:C2H6O – 12e? + 3H2O = 2CO2 +12H+
考点:本题考查化学工艺流程的分析、物料守恒、化学方程式及电极方程式的书写、离子的检验、基本仪器、燃料电池的分析。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:填空题
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如图所示:
已知:FeTiO3与盐酸反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是________。
(2)滤渣A的成分是________。
(3)滤液B中TiOCl42—转化生成TiO2的离子方程式是________________。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是________________________________。
(5)反应③的化学方程式是________________________。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)做电极组成电池,其工作原理为Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为__________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-===Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛?Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外活动小组同学用如图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。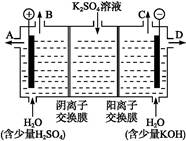
①该电解槽的阳极反应为 。
此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
微电解技术具有处理效果显著、投资少、运行费用低等优点。铝碳微电解处理就是利用铝-碳颗粒之间形成了无数个细微原电池,这些细微电池在酸性溶液中发生电化学反应。溶液中溶解一定量的氧可以增大铝的腐蚀效率,因此可以通过曝气来强化处理效果。实验装置如图:
(1)实验前,将铝屑在5%NaOH碱洗10分钟,目的是① ,② 。
(2)曝气条件下,在酸性溶液中,该装置中发生的电极反应为:铝极 ,碳极 。
(3)通过铝碳微电解法可以对含镍电镀废水进行处理,某化学研究小组研究了铝碳比、反应停留时间对处理效果的影响,结果如下:

通过分析,确定最佳工艺的铝碳比为 ,反应停留时间是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,按要求回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH,按要求回答下列问题:
(1)放电时, _______(填物质化学式,下同)作负极,充电时,____________作阴极。
(2)放电时正极附近溶液的碱性__________ (填“增强”或“减弱”)
(3)充电时,每转移3mol电子,被氧化物质的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为: ;若将该反应设计成如图的原电池,请在图中完成标注。
(2)实验证明,能设计成原电池的反应通常是放热反应,现有下列反应:
①C(s)+H2O(g)=CO(g)+H2(g) △H>0;
②2H2(g)+O2(g)=2H2O(1) △H<0 ;
③NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0 。
上述反应可以设计成原电池的是 (填序号),如若以KOH溶液为电解质溶液,依据所选反应设计的原电池其负极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
安徽凹山铁矿坐落在马鞍山境内,矿床属于陆相火山一侵入岩型铁矿床,俗称“玢岩型”铁矿,是马钢重要的矿区之一。铁矿中被称为红帘石的铁矿含锰量高,锰是冶炼锰钢的重要原料。红帘石主要成分有磁铁矿Fe3O4、菱铁矿FeCO3、锰矿(MnO2和MnCO3)石棉Mg3Si3O7(OH)4等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属锰并制的绿色高效水处理剂(K2FeO4)。工业流程如下:
(1)工业上为提高稀硫酸浸取效率一般采取的措施是(任意写两种方法)
① ②
(2)石棉化学式为Mg3Si3O7(OH)4也可以表示成氧化物形式,氧化物表达式为 。
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式: 。
II.(1)某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。
请你在方框内画出能够实现这一反应的装置图。
(2)某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com