
分析 (1)根据元素化合价是否发生变化,以及变化的趋势判断物质在氧化还原反应中的表现的性质;
(2)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,该反应转移6e-,以此来解答;
(3)先根据化合价的变化判断氧化剂和还原剂,然后根据原子守恒配平方程式,再根据电荷守恒判断n值.
解答 解:(1)2Na+2H2O=2NaOH+H2↑中,H元素化合价降低,被还原,则水只是氧化剂;反应2F2+2H2O=4HF+O2↑中,O元素化合价升高,被氧化,水只是还原剂;反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑中,H、O元素化合价变化,水既是氧化剂,又是还原剂,反应CaO+H2O=Ca(OH)2中,H、O元素化合价没有发生变化,水既不是氧化剂,又不是还原剂,综上:①水只作氧化剂的是B,故答案为:B;
②水既作氧化剂又作还原剂的是D,故答案为:D;
(2)①该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,
用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
②N元素的化合价降低,则HNO3为氧化剂,Cu元素被氧化,则氧化产物为Cu(NO3)2,
故答案为:HNO3;Cu(NO3)2;
③Cu为还原剂,HNO3为氧化剂,3molCu失去电子与2molN得到电子相同,则氧化剂与还原剂的物质的量之比为2:3,故答案为:2:3;
④该反应转移6e-,若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是0.2mol×22.4L/mol=4.48L,故答案为:4.48L;
(3)该反应中,锰元素的化合价变化为+2价→+7价,失电子化合价升高,锰离子作还原剂;氧元素的化合价不变,所以R元素得电子化合价降低,R2O8n-作氧化剂,即R2O8n-与Mn2+的物质的量之比为5:2,根据各元素的原子守恒写出并配平该方程式为8H2O+5R2O8n-+2Mn2+=2MnO4-+10RO42-+16H+,根据电荷守恒得-5n+2×2=-1×2+(-2×10)+1×16,n=2,故答案为:2.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断及计算的考查,注意从化合价角度分析,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
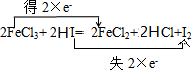 ,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.
,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应说明它是吸热反应 | |
| B. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出的热量多 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l),△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于 57.3 kJ | |
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=-297.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | z=4 | B. | B 的转化率是40% | ||
| C. | A 的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来压强的0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能.
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能.| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极 | B. | 阳极 | C. | 正极 | D. | 负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )| A. | t3 时降低了压强 | |
| B. | t5 时提高了温度 | |
| C. | t1-t2 时该反应的平衡常数小于 t6时反应的平衡常数 | |
| D. | t6 时刻后反应物的转化率最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 | |
| B. | 用10mL量筒量取8.58mL蒸馏水 | |
| C. | 容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大 | |
| D. | 用酒精萃取碘水中的I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com