
分析 先根据碳原子守恒计算四种有机物的物质的量,然后根据取代反应特点:用1个氯原子取代1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,依据碳、氢原子个数守恒计算消耗氯气的物质的量,以及生产的HCl.
解答 解:1mol CH4与Cl2光照下发生充分反应,生成相同物质的量的4种取代物,所以生成CH3Cl、CH2Cl2、CHCl3、CCl4的物质的量都是0.25mol,因为甲烷与氯气发生取代反是用1个氯原子取代1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,所以CH4与Cl2发生取代反应中消耗的氢原子和氯气分子的个数比是1:1,
所以所需的氯气的物质的量为:0.25mol×1+0.25mol×2+0.25mol×3+0.25mol×4=2.5mol,
该四种取代物中n(Cl)=0.25mol×(1+2+3+4)=2.5mol,可知被取代的H原子的物质的量为n(H)=2.5mol,即生成的HCl的物质的量为2.5mol.
答:生成各种有机物的物质的量各为0.25mol;消耗掉2.5mol Cl2 ;生成2.5mol HCl.
点评 本题考查的是甲烷和氯气的取代反应,明确取代反应中被取代的氢原子的物质的量与氯气分子的物质的量的关系是解本题的关键,注意原子个数守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mo1 O2的同时生成2n mol NO2 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | 混合气体的密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. ,结构式为H-O-H.
,结构式为H-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
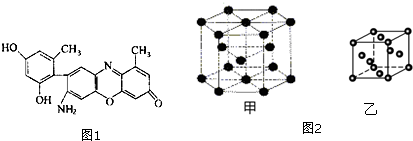
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
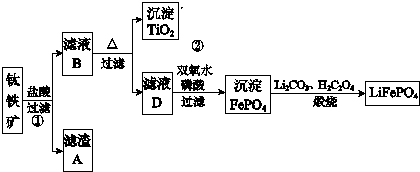
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
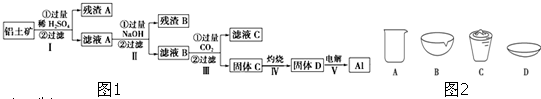
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 向盛有4g Na2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极有O2逸出 | B. | 负极附近的SO42-浓度逐渐增大 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片表面发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com