
分析 ①铜与硝酸银溶液发生置换反应生成硝酸铜和银;
②碳酸氢钠与稀硝酸反应生成硝酸钠、二氧化碳气体和水;
③氧化铁与稀盐酸反应生成氯化铁和水;
④该离子方程式表示可溶性碳酸盐与强酸反应生成可溶性盐、二氧化碳气体和水的反应;
⑤该离子方程式表示可溶性铁盐与可溶性强碱反应生成氢氧化铁沉淀和可溶性盐的反应.
解答 解:①铜与硝酸银溶液反应的离子方程式为:Cu+2Ag+=Cu2++2Ag,
故答案为:Cu+2Ag+=Cu2++2Ag;
②碳酸氢钠溶液与稀硝酸反应的离子方程式为:HCO3-+H+=CO2↑+H2O,
故答案为:HCO3-+H+=CO2↑+H2O;
③稀盐酸与三氧化二铁反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
④CO32-+2H+=CO2↑+H2O表示可溶性碳酸盐与强酸的一类反应,如:Na2CO3+2HCl=2NaCl+CO2↑+H2O,
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
⑤Fe3++3OH-=Fe(OH)3↓表示可溶性铁盐与可溶性强碱的原理反应,如:FeCl3+3NaOH=3NaCl+Fe(OH)3↓,
故答案为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓.
点评 本题考查了离子方程式、化学方程式的书写,题目难度中等,明确发生反应实质为解答关键,注意掌握离子方程式、化学方程式的书写原则是,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝比铁化学性质活泼 | |
| B. | 铝表面有一层致密氧化膜起保护作用 | |
| C. | 铝性质太活泼已经全部被氧化成了氧化铝 | |
| D. | 铁有可能只失去二个电子而铝失三个电子,从而比铝更容易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③④ | B. | 只有①② | C. | 只有①③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
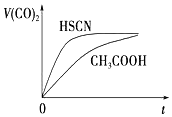 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 一学生用pH试纸测得某氯水的pH为2 | |
| C. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| D. | 配制硫酸亚铁溶液,是将晶体溶于蒸馏水再加入一定量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
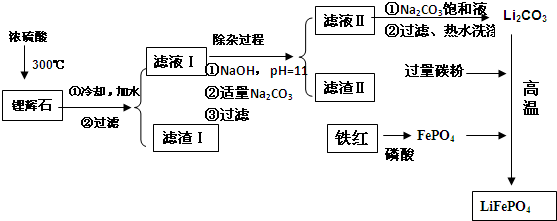
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
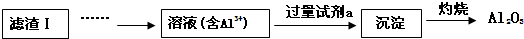
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com